Chapitre XVI L’amélioration du pain et les améliorants
XVI.1. Histoire de l’amélioration du pain.
L’amélioration du pain est souhaitable et souhaitée. En tout cas, il ne faut pas chercher à s’opposer à l’amélioration du pain, mais il est intéressant pour celle-ci de ne pas se résumer à l’apport de produits dits « améliorants » ou « adjuvants ». Si pour la production de blé bio, l’absence de pesticides vient tout de suite à l’esprit, pour la transformation du grain bio en pain bio, l’absence de produits améliorants est une approche du même type. D’autre part, déclarer ces derniers de « poudre de perlinpinpin » sans plus, risque à raison que cette attitude soit traité d’humeur, de réflexe ou positionnement primaire. Il faut se poser la question correctement : quels sont ces produits améliorants ? Pourquoi et comment ont-ils pris parfois tant d’importance dans la production conventionnelle ?
C’est ce que l’on va tenter d’expliquer en faisant dans un premier temps, une lecture critique de ce que le lobby des firmes d’adjuvants de panification appelait dans les années 1980 « le livre blanc de l’améliorant ».
On a toujours voulu améliorer le pain et d’après les firmes d’avant produits, les premiers améliorants ont été le sel et la levure.
C’est exact en partie, le sel n’est entré en panification que vers le xviie siècle en France (XIV.1).
À cette époque, il faut le dire, on employait des farines souvent plus complètes, et l’on panifiait au levain. Ces pains contenaient ainsi plus de sels minéraux (pour la farine intégrale, jusqu’à 50 % de plus que dans une farine blanche) et possédaient une saveur plus prononcée.
Les premiers traités professionnels datent du xviiie siècle et lorsqu’ils évoquent l’emploi du sel, il le présente davantage comme une possibilité, plutôt qu’un impératif [1]. Malouin dit que les Anglais et les Allemands salaient plus le pain, ainsi, lorsqu’ils venaient en France, ils trouvaient le pain fade. Il faut dire aussi qu’autrefois, la teneur en sel dans la pâte à pain variait beaucoup. En pays de bord de mer ou en pays de mine de sel le pain est déjà salé depuis longtemps [2]. Les régions côtières avaient non seulement les salines, mais avaient parfois la permission d’utiliser l’eau de mer pour saler le pain[3].
L’agronome ou dictionnaire portatif du cultivateur publié à Paris en 1742, écrit : « Il y a des endroits où l’on sale le pain et d’autres où on ne sale point ». D’autre part, Parmentier ne donne-t-il pas dans l’écrit écologique lorsqu’il écrit[4] que le sel et la levure paraissent tempérer les effets l’un de l’autre. Plus loin, il dit que les Anglais ne se servent que d’un levain mal fait à la levure et que pour cette raison ils mettent « force sel ». Parmentier conseille d’ajouter le sel pour rectifier l’amertume des mauvaises farines et Malouin pour améliorer la tenue des pâtes. Pour conclure sur le sel, n’oublions pas que de nos jours, il nous faut en diminuer la dose (XIV.1).
En ce qui concerne la levure, il faudra attendre sa commercialisation par l’industrie à la fin du xixe siècle (XV.3) pour voir son emploi se généraliser. Avant cela, c’est dans les pays de bière que l’on en aura principalement usage. De plus c’est de nouveau pour des pains blancs que l’on a commencé à pratiquer de la sorte[5]. Pour preuve deux autres citations historiques. Malouin écrit : « Dans les premiers temps de l’usage de la levure, on ne l’employait que pour faire les pains à café et autres petits pains [c’est-à-dire de pâte blanche en portion individuelle], ensuite on s’en est servi pour faire tout pain mollet, tout pain de pâte molle [pâte de pains blancs] », et « en Allemagne, on ne se sert jamais de levain pour composer le pain blanc, on fait un levain avec de la levure, trois ou quatre heures avant de pétrir ». Plus loin, il écrit à l’inverse « qu’on ne met point de levure au pain bis ». Un pharmacien établissant un vocabulaire wallon du métier en 1894 mentionne qu’« on emploie [le levain] pour fabriquer les pains autres que le pain blanc et les pains de luxe[6]. »
XVI.2. Histoire de l’améliorant de panification
En France, le syndicat national des fabricants de produits intermédiaires pour boulangerie, pâtisserie et biscuiterie (Syfab) a été créé en 1965. Ce syndicat regroupe à ce jour 25 sociétés adhérentes[7]. En Belgique, l’Unifa[8], créé dès 1956, unit les intérêts de l’industrie belge des matières premières pour la boulangerie, en tant qu’interlocuteur au niveau législatif, des salons professionnels, de l’enseignement, de la publicité obligatoire sur emballages et de la sécurité alimentaire.
Existant depuis 1969, la Fedima (fédération des fabricants et fournisseurs européens d’ingrédients pour les industries de la boulangerie, confiserie et pâtisserie[9]) regroupe au niveau européen les divers lobbys nationaux des firmes productrices d’ingrédients pour la boulangerie-pâtisserie, notamment le Syfab et l’Unifa précités.
Comme les législations de libre circulation des produits sont, bien avant l’ouverture du grand marché européen de 1992, du ressort de la Cee, c’est principalement dans cette entité politique que se débattent les enjeux et stratégies de ce secteur.
Le « livre blanc » de l’améliorant portait le titre « Le pain ? Pas de problème ! ». Cette plaquette de 1988 reprend l’assise rédactionnelle d’une autre plaquette intitulée « Le pain, aliment de polémique où nourriture de l’homme ? » Avec ces titres, on nage en pleine équivoque. Ce dernier fascicule avait été édité par la fondation Puraland, association technique et temporaire de deux firmes d’adjuvants : Puratos et Zeelandia[10]. Depuis l’Unifa belge a mis en téléchargement en 2006, une autre publication de 67 pages reprenant moins la controverse existant entre secteurs d’activité et intitulée « La boulangerie d’aujourd’hui[11] ». Citons deux passages ; d’abord la page 14 de ce texte. Les adjuvants « sont tellement complexes que le boulanger ne peut les fabriquer lui-même », et dans les conclusions : « il vaut mieux se tenir au courant des matières premières modernes ou des adjuvants composés qui peuvent vous aider ».
Une petite différence entre la France et la Belgique est l’expression « adjuvant » venue en Belgique, en 1985, remplacer dans les textes législatifs l’expression « améliorant » et cela après maintes discussions. Il faut dire que l’emploi du terme améliorant a été pas mal galvaudée à ses débuts, il était « très chimie pure ». Jugez-en, avec ces recettes d’améliorants de panification des années 1930. Une partie de bromate de potassium et deux parties de persulfate d’ammonium associés à 70 % de phosphate de calcium donnait le glutabase, ou avec 73% de phosphate de calcium, le glutine B, les deux améliorants sont traités alors de « gluten synthétique » (XVI.4.7.). Ces recettes sont données en janvier 1931 par le docteur en pharmacie M.P. Creissent dans « L’avenir de la Pharmacie[12] ». De quoi comprendre le galvaudage du terme « améliorant » et que l’on veuille changer la dénomination ; d’améliorants en adjuvants.
Pour connaître l’histoire des améliorants de panification et non de l’amélioration du pain, il nous faut aller lire l’historique des entreprises proposant ces ingrédients.
Les firmes qui se disent pionnières sont apparues sur la scène économique principalement dans l’entre-deux guerres.
Zeelandia[13], comme son nom l’indique, a débuté en Zélande, province néerlandaise, chez H.J.Doeleman, boulanger de Zierikezee. C’est dès 1900 que commence l’activité de la firme par l’action d’une machine encore mue grâce à la vapeur à l’époque, une Stoombeschuitgeleifabriek soit, Fabrique à vapeur de gelée pour biscotte. C’est une petite manufacture ou l’on réalise cette gelée pour biscotte[14].
Produit aux composants qui étonnent aujourd’hui. Celle-ci peut être composée d’ajout de produits naturels comme le sucre et la lécithine, mais aussi (pas toujours), de savon de Marseille et de potasse[15].
Dans le contexte de l’époque (début du xxe siècle), cela n’était pas curieux. L’innovation tenait alors de l’avancée par la meilleure connaissance et application de la chimie.
Pour la panification, on retrouve une mention de savon dans la pâte à pain, déjà en 1658 à Liège[16]. L’archive dit ceci ; « ils [les boulangers] ne pourront mêler ou mettre avec aucune sorte de pains blancs…du lait, œufs, beurre, graisse, savon ou chose semblable ». Au xviiie siècle, on cite l’introduction de savon dans la pâte, mais cela est interprété en termes de sabotage de la part d’ouvriers vis à vis de leurs patrons[17].
Ce savon mentionné au xviie siècle étant probablement le produit basique de la matière savonneuse, c’est-à-dire de la matière grasse, le produit le plus plausible semble le saindoux, vraisemblablement mélangé avec de la potasse (cendres de bois macérée puis lavée dans l’eau). C’est ce même principe (produit alcalin sur matière grasse) qui donne par mégarde le goût de savon à une pâte sablée lorsque l’on applique directement la poudre levante ou baking sur le beurre.
Cette « gelée » qui peut être considérée comme un des premiers produits adjuvants de panification, était destinée à une marchandise spécifique, presque diététique, la biscotte hollandaise. Il a été conçu pour donner à celle-ci, une mie bien développée et une friabilité caractéristique. Viendront ensuite les « crèmes à pain » et en 1935 « Zéa », le premier véritable améliorant complet pour pain aux dires de la firme.
Ces biscottes hollandaises sont déclarées comme ayant une meilleure valeur alimentaire, puisqu’elles contiennent des matières grasses et des œufs, alors que les autres zwieback (pain cuit deux fois) comme les dénomment les allemands, rappellent plutôt la simple tranche de pain grillée. La dureté du produit toasté est évitée suite à ces ajouts d’ingrédients précités et la biscotte en devient plus friable. D’où le succès hors frontière de la biscotte hollandaise, qui contient de la graisse émulsifiée (XVI.4.5) qu’est la gelée pour biscotte.
La biscotte hollandaise fabriquée en France avant la nouvelle réglementation CE sur les additifs alimentaires ne pouvait contenir qu’un taux maximal de 1,5 % de datas esters (E 470, E471, E472) calculé sur la farine[18].
L’autre firme analysée et pionnière en améliorant de panification est belge.
Puratos[19] débuta en 1919 grâce à Henri Groot et son fils. Après avoir été un temps la représentante belge d’une firme néerlandaise proposant de la gelée pour biscotte, Puratos lança assez vite le premier pain de marque le Pura-Malté en 1923[20]. Leur produit phare, l’améliorant de panification le T 500, débuta en 1953, il deviendra en 1975, le S 500 (version poudre améliorées) et depuis 2018 existe, le S 500 labélisé bio. L’entreprise se dit familiale après la fusion en 1997 de la firme de deux familles belges (celle de François Van Belle et Pierre Demanet, respectivement comptable et chimiste de formation) avec celle de deux familles catalanes propriétaires de T500 Iberica. La firme est présente dans plus de 100 pays grâce à ses filiales et partenaires. Dans la firme, une diversification d’activité est enclenchée dans les années 1980, production de margarine, chocolat, enzymes, levure, levains séchés.
Une autre firme dont nous ferons l’historique en abrégé, nous permet de voir l’évolution dite en inévitables restructurations. C’est Diapharm qui deviendra Diafarm. Crée en 1946 par un hollandais installé en Belgique, elle traitait au début des extraits de malt et aussi des produits pharmaceutiques, d’où sa première dénomination. Elle lança en 1958 le pain « Expo ». Elle fut rachetée en 1969 par la compagnie laitière néerlandaise Friesland qui trouva ainsi un débouché direct pour ses excédents laitiers à travers la commercialisation de poudres – mixes, pour crèmes, cakes, glaces, etc. La coopérative Friesland fusionnera avec l’autre grande coopérative laitière néerlandaise, Campina en 2008 et on perd la trace de Diafarm.
Dans les années 1960-1980 la boite aux lettres des boulangers regorgera d’informations plus publicitaires que permettant vraiment le discernement technologique.
C’est clair, le but de ce secteur des firmes fournissant des produits intermédiaires aux boulangers est « d’améliorer » la vie de ses clients, mais interrogeons-nous aussi en tant que professionnel sur la qualité du pain !
Les années les plus glorieuses des améliorants sont l’époque où on mentionne un triplement du chiffre d’affaires de la division belge de Zeelandia[21] de 1960 à 1972. Chez Puratos on a multiplié le chiffre d’affaires par dix entre 1968 et 1982 (inflation comprise).
Les orientations de la politique agricole commune (Pac) de l’Union Européenne furent une véritable aubaine pour l’industrie de l’améliorant : elles favorisèrent les blés européens au détriment des blés de force importés d’Amérique du nord.
John Yudkin, professeur de nutrition et diététique à l’Université de Londres, écrit [22]dans les années 1980 : « La méthode de fermentation courte [due au pétrissage intensif, (XVIII.3)] élimine le stade initial [le pointage] par l’adjonction de l’acide ascorbique. L’avantage principal de ce procédé est de produire un bon pain avec une farine contenant moins de protéines. Ce qui permet de faire passer la proportion de blé non importé en Grande-Bretagne de 40 à 65 % dans la panification ».
Dan Morgan, journaliste d’investigation au Washington Post va dans le même sens que John Yudkin lorsqu’il écrit que, vers les années 1970, « les boulangers anglais et européens pris entre la hausse de leurs coûts et le contrôle du prix du pain se tournèrent vers des procédés de panification nécessitant moins de blé riche en protéines, spécialité du Canada[23] ». Il s’agit ici de choix de politique économique plus qu’une réflexion sur le blé de qualité technologique. Ce sera une porte ouverte à une application un peu « soignante » de l’améliorant sur des farines de moindre « qualité boulangère » et permettra à ce secteur de produits améliorants de faire évoluer le développement de la mie jusqu’à la pousser à son maximum d’expansion.
Dans les années 1980, les grandes meuneries proposeront des mélanges farine plus améliorants (mixes ou farine prête à l’emploi), afin d’élargir leur gamme de produits. Ce qui ne manquera pas de créer en Belgique des différents entre les fabricants d’adjuvants et le secteur meunerie admis à la table du comité interprofessionnel de concertation[24] (Cic). La dispute s’articulera autour de ces « mixes » boulangers (farine + adjuvants), un produit à la frontière des deux secteurs d’activité.
Quelques exemples « marketting » sur le marché belge : Le pain Panda créé par Zeelandia en 1989, la Tartine Schtroumpf (Puratos en 1985), le pain Breughel (Debco-Unilever en 1986).
En France, la Sam (Société Auxiliaire de Meunerie) de Charenton-le-Pont près de Paris proposait principalement de la farine de fève, elle cessera ses activités dans les années 1990.
Le syndicat promoteur de la farine de fève ne manquera pas de mettre en avant le caractère naturel (XVI.4.3) de cette farine de fève, lors du lancement par la confédération du pain de tradition en 1993[25].
Eurogerm, la firme des environs de Dijon, a été créé en 1989 et son institut technique (Arpèges) en 2001[26].
XVI.3. De la gelée pour biscotte à la « naturalité » des enzymes.
Si dans le début du xxe siècle, c’est la chimie qui est source d’innovation, un siècle après, la donne change. Au point que l’on va tenter d’effacer ce passé de la part des firmes initiatrices et se voulant innovantes.
Sur le site internet d’une de ces firmes d’améliorant, dans la rubrique historique, j’observais une photo en toile de fond mise à l’envers ! Intrigué, je parvins à la retourner et lire ce qui était inscrit sur les bidons de la photo devant lesquels se postaient les premiers ouvriers de la firme. Il s’agissait de bidons de gelée pour biscottes (Beschuitaola). J’ai compris que le fabricant ne voulait plus en parler. Que l’on passait à autre chose, à une autre époque.
Fin du xxe siècle, le décret pain, d’octobre 1993 va d’ailleurs exclure les additifs sous l’appellation « tradition française ».
L’écartement de plus en plus prononcé par les consommateurs de ces codes européen (E…) à trois chiffres sur l’étiquette va ouvrir des potentialités aux possibilités de remplacement par des produits plus naturels. La promotion de la levure désactivée, de la poudre de levain et surtout des enzymes s’accompagna de ce que d’aucuns appellent la « naturalité » [27].
D’autres entreprises meunières productrices d’ingrédients ou mixes se spécialisent dans la formulation d’enzymes qui est un métier à part. En effet composer des cocktails enzymatiques propres à la récolte de l’année et aux demandes spécifiques d’entreprises est un travail différent que de produire les enzymes.
Toutefois, avec l’ajout d’enzymes, il y a une différence importante par rapport à l’ajout d’améliorants contenant des additifs. Les enzymes, parfois nommés « régulateurs » en meunerie, sont directement inclus à la farine. Ils ne sont pas ajoutés par les artisans eux-mêmes sous forme de poudre ou intégrés dans du gras émulsifié par exemple. Ceux-ci ne posent même plus le geste. Ils réceptionnent des farines « corrigées » sans qu’ils aient vraiment choisi l’ajout. Cette absence de choix de l’ajout de la part de l’artisan risque fort de standardiser un secteur artisanal pourtant plus propice à la diversité qu’à l’uniformisation et devient « hémorragique » au niveau de la compétence professionnel de l’artisan.
Il est vrai que la mise au point d’enzymes exigeant de lourds frais d’expertise et de formulation spécifique ne peut pas facilement être un engagement de petites firmes.
Le relevé des composants des améliorants pour la boulangerie courante que nous allons approfondir s’appuie sur le document, « La Boulangerie d’aujourd’hui[28] » de l’Unifa et sur le support pédagogique du site du Syfab[29].
XVI.4. Les ingrédients des améliorants de panification
Passons-les en revue !
XVI.4.1. Les sucres
Le sucre est un produit, dit ingrédient naturel, même s’il subit lors de la transformation de la betterave en sucre raffiné, des traitements physiques et chimiques[30].
Dans le cas du sucre ajouté, c’est souvent du sucre simple de la part du boulanger, composé de saccharose (une molécule de glucose + une molécule de fructose). Mais on peut le retrouver sur l’étiquette avec un nom plus issu du langage scientifique : dextrose, ou D-Glucose et venant de la transformation d’hydrates de carbone divers, souvent les moins onéreux.
La quantité de sucres ajoutés en boulangerie courante n’a rien à voir avec la dose employée en boulangerie fine (pâtisserie). Ici, il ne s’agit que d’aide à la fermentation (ajout d’environ 1 % sur matières sèches), pour que celle-ci s’active plus vite, mais plus, (vers les 10 % d’ajout), sera au risque d’apporter le début des effets inhibiteurs du sucre sur la fermentation (XV.5).
On remarque que lorsque ne sont présent que les sucres simples natifs de la farine, c’est le maltose (di-saccharide) qui sera le dernier sucre simple dégradé par les microorganismes de la fermentation, ce qui est également le cas lors de la digestion humaine (VII.5).
Dans un graphique décrivant la consommation des sucres de la pâte avec ajout de 5 % de sucre glucose au kilo de farine, ce sera le glucose qui sera le premier consommé (ou dégradé) avant le fructose et en dernier le maltose. P.Clément de Lesaffre donne un autre tableau de Atkin de 1946 ou il apparait clairement que le glucose est nettement plus vite consommé par la levure de l’époque, que le maltose[31]
On nourrit la levure d’autres sucres qui peuvent parfois être à la frontière technologique entre le sucre et les enzymes, c’est-à-dire les farines de malt ou extraits de malt (XVI.8).
XVI.4.2. Le lait en poudre
Ce produit suit la transformation propre aux laiteries (homogénéisation, pasteurisation, micronisation, parfois écrémage) puis subit un séchage assez vigoureux.
Le lait en poudre est un apport important en lysine, un des acides aminés, (l’unité protéique) qui participe à l’élaboration de la croute. Un acide aminé qui est justement faible proportionnellement et parfois facteur limitant dans les céréales (VII.7).
En plus, des extraits, les particules de caséine et caséïnates, sont autorisées en Belgique[32]. Elles auraient la propriété de lisser les farines au toucher.
XVI.4.3. Les farines de légumineuses.
L’observation de l’amélioration qu’apporte la farine de fèves en panification est venue très tôt en boulangerie. Les égyptiens suivi des grecs et des romains l’introduisaient déjà dans le pain[33].
En panification française, elle fut déjà autorisée le 22 avril 1854, initiée par Pierre Prat et produite par les Grands Moulins de Plombières-lez-Dijon[34]. On remarquera de manière empirique qu’un ajout de cette farine apporte plus de volume au produit final. Après ce sera sur la correction de la forte teneur en gliadine du froment que la farine de fève agit, d’après Émile Fleurent[35]. D’autres chercheurs écrivent en 1936, que l’apport de farine de fève « agit comme un activateur initial de la fermentation », ce qui est considéré comme un intérêt pratique puisque l’on considère à l’époque, que « la fermentation doit être conduite rapidement »[36].
Actuellement l’ajout à une farine dite de froment est règlementé. L’autre farine de légumineuses employée est souvent la farine de soja, plus riche encore en enzymes lipoxygénases[37] que la farine de fève. Pour cette raison, on renseigne que la dose maximale n’est que de 0,5 % de farine de soya autorisée au lieu de 2 % en farine de fèves.
L’activité de l’enzyme lipoxygénase (en abrégé, LPOX) de la farine de fève est classée dans les enzymes oxydases (qui oxydent la pâte). Sa capacité d’oxydation est 100 fois supérieure à l’activité de la lipoxygénase native du blé. Cette activité enzymatique de la farine de fève est même triplée, si c’est de la farine de soja qui est utilisée.
Elles génèrent, surtout lors de pétrissage important et rapide, des gaz « dénaturants ». Dans les années 1960-1970, arrivées à un plafonnement de l’intensification du pétrissage, l’ajout de farine de fève contenant plus d’enzyme oxydante contribuait largement dans la pâte ainsi pétrie à détruire les pigments caroténoïdes. Cela concourait dans le produit cuit à produire un gaz (l’hexanal) et n’est pas habituel dans le goût du pain (XVI.11.3), il formait une odeur de formaldéhyde[38] et rendait le pain fade[39].
Par cet exemple, on remarque que même si la farine de légumineuse est un produit naturel, sa présence en panification est technologique, et qu’en plus elle peut, malgré le respect des doses, dégrader la qualité du pain, plutôt que l’améliorer. En octobre 1993, dans les premiers temps de la publication du décret « pain de tradition », le syndicat national [français] des fabricants de farine de fèves publia une publicité en précisant que la farine de fèves est un « produit naturel » et qu’elle peut être choisie pour « faire partie des composants du pain de tradition française[40] ».
XVI.4.4. La margarine.
Comme pour l’ajout de matières grasses à la pâte, il s’agit rarement de beurre en panification courante, mais de margarine, il faut quand même préciser que ces graisses (d’origine animale ou végétale) incorporées dans sa composition doivent être hydrogénées, ce qui permet de durcir les huiles liquides et de les transformer en graisses solides. Elles subissent ainsi des transformations physiques et chimiques. Le raffinage obligé des extraits gras d’animaux ou de végétaux comprend un dégommage éventuel qui est l’élimination des substances « colloïdes », une neutralisation chimique qui élimine les toxines et acides gras libres, un lavage qui élimine les traces de soude employées dans le procédé, puis s’ensuit un séchage, une décoloration, un décirage, une désodorisation[41] afin d’être ce produit commercial plus ou moins récent qu’est la margarine.
Celle-ci fut créée par le français Hyppolite Mège-Mouriès en 1869. La défaite française lors de la guerre de 1870 contre la Prusse devenant l’Allemagne unifiée en janvier 1871 ne permettra pas au chercheur français d’exploiter son invention, il vendra son brevet à plusieurs entreprises. En premier, à l’entrepreneur néerlandais Antonius Johannes Jurgens, dont l’entreprise Margarine-Unie deviendra la multinationale agro-alimentaire Unilever en fusionnant en 1930, avec le fabricant anglais de savon, Lever Brother[42].
Inévitablement, la margarine sera composée d’acides gras saturés. L’hydrogénation a pour but de réduire l’insaturation des corps gras et corrélativement d’améliorer leur stabilité vis-à-vis de l’oxydation ou rancissement[43]. Un avantage technologique pour un désavantage nutritionnel (VII.8).
Rappelons que l’on cite souvent le pain comme un aliment ayant la capacité de rééquilibrer le bol alimentaire, car il n’est pas trop riche en graisses, devenues elles souvent excédentaires dans la ration alimentaire[44].
Dans la pâte, l’ajout de matières grasses pourrait être regardé comme non-indispensable nutritionnellement surtout lorsqu’on sait que ceux qui en ont envie beurrent souvent les tranches de pain et que les matières grasses passées au four ne gagnent pas en valeurs nutritives, bien au contraire. Nous avons vu (VII.8), les incertitudes nutritionnelles que l’on pouvait avoir avec les matières grasses cuites[45].
Alors pourquoi en mettre en terme d’améliorant en panification ?
Pour rendre la mie moins émiettable, c’est une amélioration de la structure qui est recherchée.
On en ajoute également pour pouvoir trancher le pain plus vite. Les machines à trancher le pain commencèrent dès les années 1930 sur le marché américain dominé par le pain de mie.
Aux états-Unis pendant la Seconde Guerre mondiale une interdiction frappe le tranchage du pain pour éviter le gaspillage de pain séché passant dans les déchets alimentaires. Mais cette loi ne tient pas plus de trois mois. En Europe continentale, c’est après la guerre et la reconstruction qui suivit, que les machines à trancher le pain s’installèrent dans les boulangeries vers les années 1960, du moins dans les pays de pain en mie. Les pains plats ou plus en croute n’étant pas appelé à être tranchés après cuisson, puisque ne se consommant pas sous formes de tartines. L’arrivée de la demande de pains tranchés influencera l’incorporation de matières grasses dans les pâtes pour pains genre « toast ».
On écrira parfois que les matières grasses apportent aussi une meilleure conservation, ce qui peut se discuter en termes d’efficacité, du moins en comparant à d’autres produits ajoutés ou méthodes naturelles de panification, tels que le levain.
 Dans l’ajout de matières grasses existe donc un effet dit « texturant » ou « conditionneur » propre aux pains de mie et propre à un travail de plus en plus intensif. Mais la dose d’incorporation de matières grasses ne doit pas être trop importante. C’est de l’ordre de 0,5 % jusqu’à 3 % pour les pains dits spéciaux[46] dans la loi belge. Le type de matières grasses ajoutées (formes libres ou complexes) est à étudier également (IX.7) et sera approfondie au sous-chapitre suivant (XVI.4.5) traitant des émulsifiants.
Dans l’ajout de matières grasses existe donc un effet dit « texturant » ou « conditionneur » propre aux pains de mie et propre à un travail de plus en plus intensif. Mais la dose d’incorporation de matières grasses ne doit pas être trop importante. C’est de l’ordre de 0,5 % jusqu’à 3 % pour les pains dits spéciaux[46] dans la loi belge. Le type de matières grasses ajoutées (formes libres ou complexes) est à étudier également (IX.7) et sera approfondie au sous-chapitre suivant (XVI.4.5) traitant des émulsifiants.
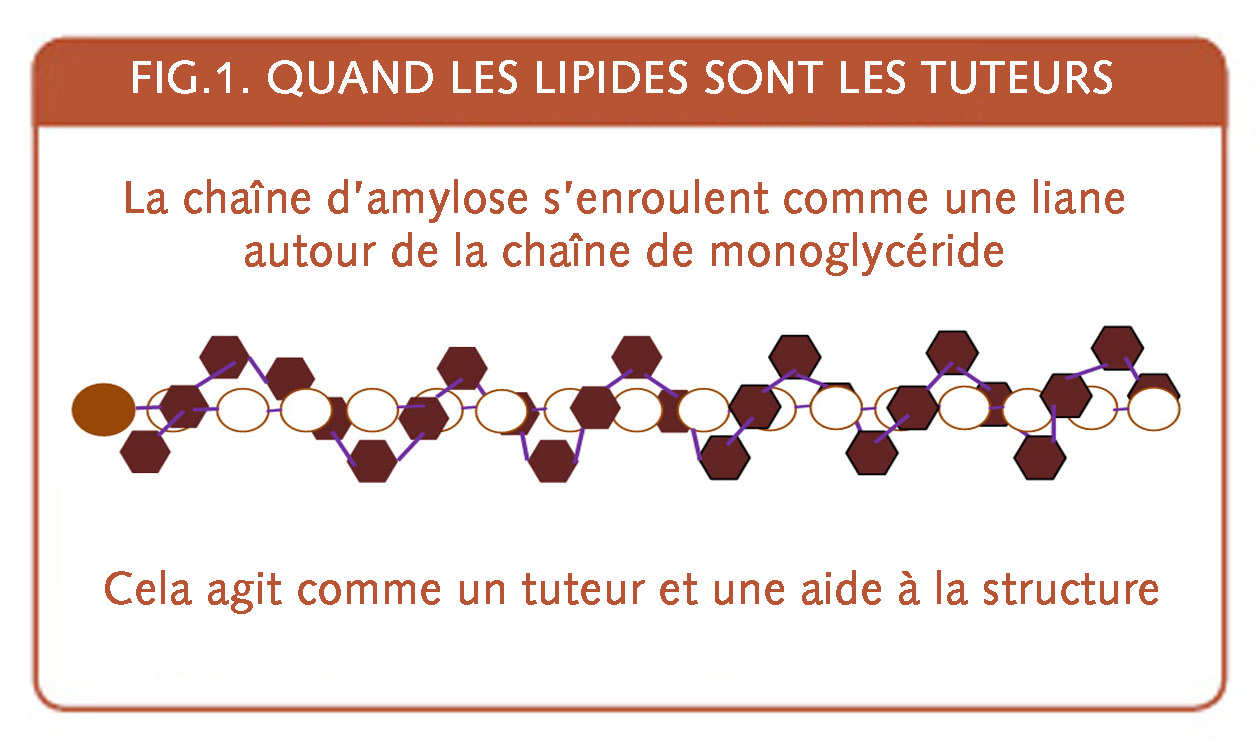
Pour comprendre par une image l’effet dit texturant de la matière grasse dans le pain, c’est comme un effet dit stabilisateur des matières grasses agissant presque comme tuteur autour desquelles s’enroulent comme une liane des bouts de chaînes d’amidon (fig.1).
XVI.4.5.Les additifs émulsifiants.
L’ajout d’émulsifiant va prendre de plus en plus de place à mesure que les matières grasses seront plus utilisées. Il va en quelque sorte faire « digérer » par le milieu pâteux les matières grasses ajoutées.
En effet, les matières grasses ne sont pas facilement miscibles dans la pâte de farine de froment. C’est dans les pays de pain de mie, que l’émulsifiant s’invite avec des procédés de panification de plus en plus rapides qui seront dénommés fièrement no-time au niveau temps d’élaboration, en raccourcissant principalement les temps de fermentation.
Dans ces procédés no-time, le plus connu, le Chorleywood Bread Process (C.b.p.), ajoute au kilo de farine, 75 ppm d’acide ascorbique, 0,7 % de matière grasses et puis surtout le pétrissage est très intensif [47]. Technologiquement, le pain de mie en devient progressivement plus le résultat d’une émulsion que d’une fermentation.
 Approfondissons la question : qu’est-ce qu’un émulsifiant pour comprendre?
Approfondissons la question : qu’est-ce qu’un émulsifiant pour comprendre?
En expliquant de manière imagée, on donne souvent l’exemple de l’huile que l’on essaie de mélanger à l’eau. On obtient une émulsion quand ces deux corps se mélangent et que l’huile se disperse dans l’eau.
Le lait est par exemple composé d’eau et de matières grasses qui sont bien disséminées et intimement liées dans le liquide, ce qui lui donne cette couleur blanche et apparence opaque.
Les laits de riz ou d’autres céréales sont parfois rendus plus blancs, en y incorporant simplement un peu de matière grasse émulsifiée.
La mayonnaise est souvent présentée comme l’exemple type de l’émulsion, l’œuf permet à l’huile et l’eau de se mélanger parfaitement, cela tient à la propriété émulsifiante du jaune d’œuf, qui se dit lekithos en grec, d’où le mot lécithine (E 322 en code européen des additifs).
C’est pourquoi, lorsque vous oubliez le sel dans une pâte et que celle-ci ne devrait plus être trop re-travaillée, pour introduire plus vite le sel oublié, mélangez un œuf avec la portion de sel pour faciliter son incorporation.
Voilà ce que c’est « d’aller voir » ce que sont les améliorants, on peut en retirer des petits trucs tout simples et… naturels.
En panification on a souvent appelé les émulsifiants, des agents « tensio-actifs », puisqu’ils modifient la tension existant entre deux surfaces ou corps ne se mélangeant pas bien en réduisant de manière active, « la tension » entre l’eau et le gras. L’émulsifiant a un côté qui est hydrophile (qui aime l’eau) et l’autre côté hydrophobe (qui n’aime pas l’eau) et lipophile (qui aime le gras). Et comme qui se ressemble, s’assemble, l’émulsifiant vient lier ces deux phases, eau (hydro-) et graisse (lipo-) en jouant l’intermédiaire. Technologiquement, la qualité émulsifiante est apprécié suivant son équilibre hydrophile / lipophile, dit système HLB – Hydrophilic Lipophilic Balance (fig.2). La lécithine de soja a un HLB de 4, si c’est de la lécithine de soja déshuilé ce sera 7. Et c’est 9,2, pour le fameux E 472c, l’ester diacétil tartrique de monoglycérides[48].
Après l’explication du rôle de l’émulsifiant, que vient-il faire dans une pâte à pain où la farine et l’eau s’entendent depuis des millénaires à s’accorder par le pétrissage et surtout la fermentation ?
On l’a vu, les émulsifiants s’appliquent bien pour la technologie du pain « toast », que l’on voulait bien développé, et aussi puisqu’on a voulu assez vite le proposer prétranché au consommateur. Le tout grâce à l’apport de matières grasses qu’ils aident à s’intégrer à la pâte.
La lécithine de soja (E322) est un émulsifiant extrait par solvant à raison de 3 %, hors de l’huile de soja. C’est un phospholipide au même titre que le jaune d’œuf.
En boulangerie, elle sera souvent employée pour lutter contre le cloquage se produisant presque comme un signature du choc thermique subi par la croute des pains allant du surgélateur ou chambre froide, au four (XVIII.6).
Dans l’explication du rôle de l’émulsifiant et des corps gras dans le pain, remarquons que glycéride est un terme neutre qui s’applique aux corps gras en général. Puis voyons de plus près l’E 471, le monoglycéride, la matière grasse déjà émulsifiée, enfin je devrais dire l’unité de matière grasse émulsifiée. C’est une matière grasse qui comme le savon ne graisse pas les mains. Parfois on ajoutera à la pâte, plutôt des di-glycérides qui résistent mieux à la cuisson.
Les matières grasses sont généralement composées de tri-glycérides, la forme la plus présente des lipides . Le beurre a des chaînes d’acide gras butyriques plus courtes (fig.3), il est de ce fait plus facilement miscible dans la pâte.
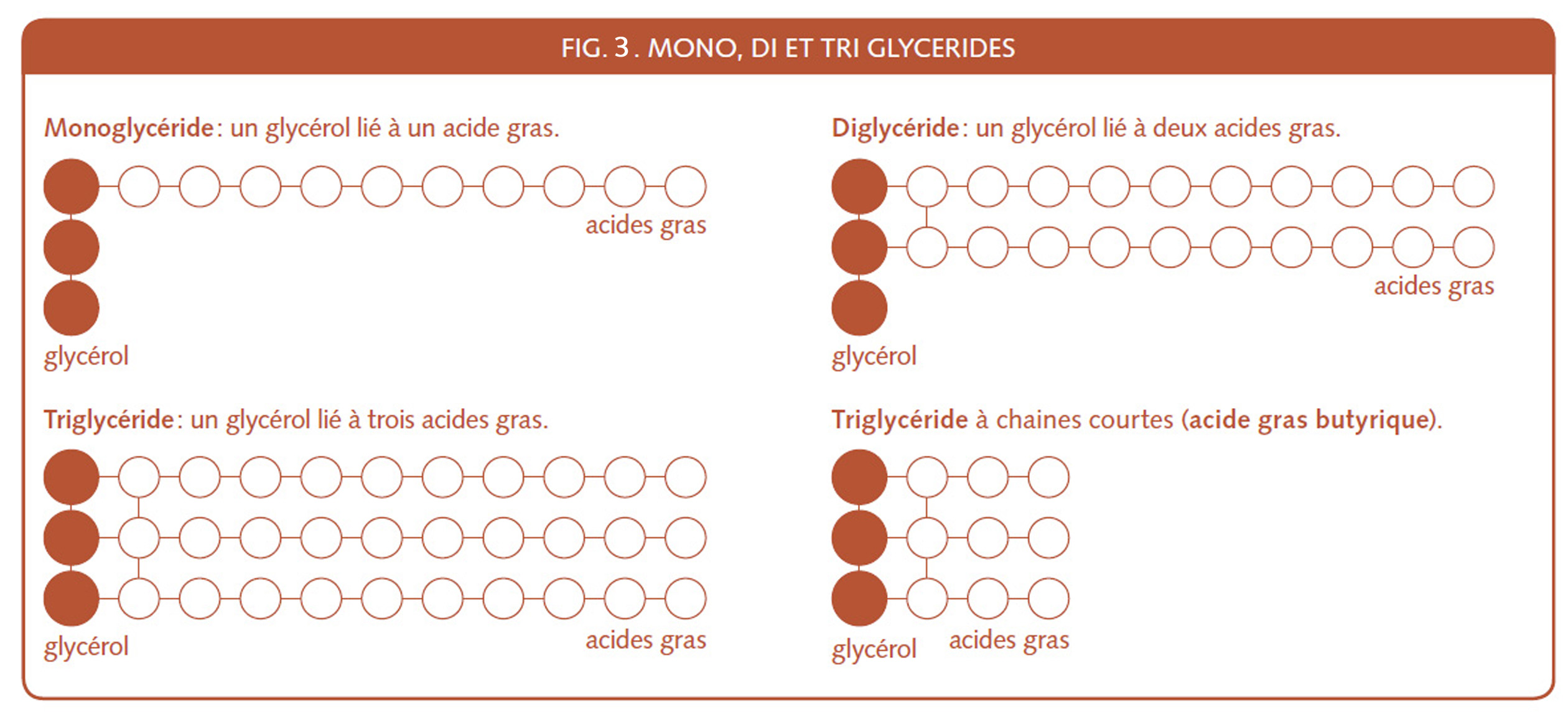
Le lait sera une émulsion H/E (Huile dans Eau) comme la crème (le gras du lait) mais ce dernier a déjà plus « d’huile dans l’eau » et le beurre est une émulsion E/H, (Eau dans Huile).
Les trois quarts des émulsifiants de produits de cuisson utilisés sont des E471 ou E472, le chiffre du code alimentaire. Déjà en 1971, aux états-Unis, dans les industries de cuisson, on en produisait 45 000 tonnes, soit 50 % de la consommation d’émulsifiants[49]. Les mono- et di- glycérides d’acides gras étaient le poids lourd de la catégorie des émulsifiants.
Il existe aussi d’autres émulsifiants employés en boulangerie que les E 470 et consorts qui n’étaient pas autorisés[50] en boulangerie courante française avant 1997. Par exemple des stéaroyls 2-Lactilate, codés E482 pour l’étiquetage.
En France, c’est la baguette qui domine les ventes en boulangerie, elle n’a pas les mêmes besoins que le pain de mie. Les data-esters des monoglycérides, comme les anglophones appellent parfois les sels diacétyl tartriques ou E472c, n’étaient autorisés en France que pour des pains spéciaux avant l’harmonisation des législations alimentaires en 1997. Il faut dire que cet exercice d’harmonisation réglementaire entrepris par l’Union européenne ne peut pas éviter les effets pervers d’alignement des législations sur le plus petit dénominateur commun. On tire rarement les produits vers la qualité, de ce fait.
Excepté pour le pain de tradition française qui voulait bien marquer l’ancienne spécificité des lois françaises sur le pain, qui ont toujours été les plus strictes au niveau d’ajout d’additifs en panification.
L’additif E472c est l’acide tartrique résultant de l’estérification (séparation acide et glycérides) des monoglycérides, il va parfois avoir le petit effet de la poudre à lever (baking) et peut facilement rassurer les chercheurs de gain de développement, qu’il peut procurer.
Au-delà de tous ces effets, on peut se poser la question : le pain doit-il ressembler toujours plus à une émulsion au même titre que toutes ces mousses lactées bien « conditionnées », ou bien doit-il conserver son identité bien ancrée, celle d’un produit résultant d’un mélange de farine, d’eau, de ferment et de sel, adéquatement fermenté et cuit ?
XVI.4.6. Le gluten vital
La poudre ou concentré de gluten (dit, gluten vital) est obtenue hors de la farine de froment.
Celle-ci subit une espèce d’« essorage » pour en extraire toutes les parties insolubles (le gluten). Après l’extraction suit le séchage pour lui permettre de se conserver.
C’est un sous-produit d’amidonneries, qui sépare l’amidon des protéines du blé et de plus en plus issu d’unités de production de bioéthanol (IX.7) s’intéressant aux hydrates de carbone du blé (l’amidon) en ayant comme résidus de production, les protéines insolubles (gluten).
XVI.4.6.1. L’augmentation de la demande
La demande de poudre de gluten vital a explosé dans les vingt dernières années du xxe siècle et début du xxie siècle.
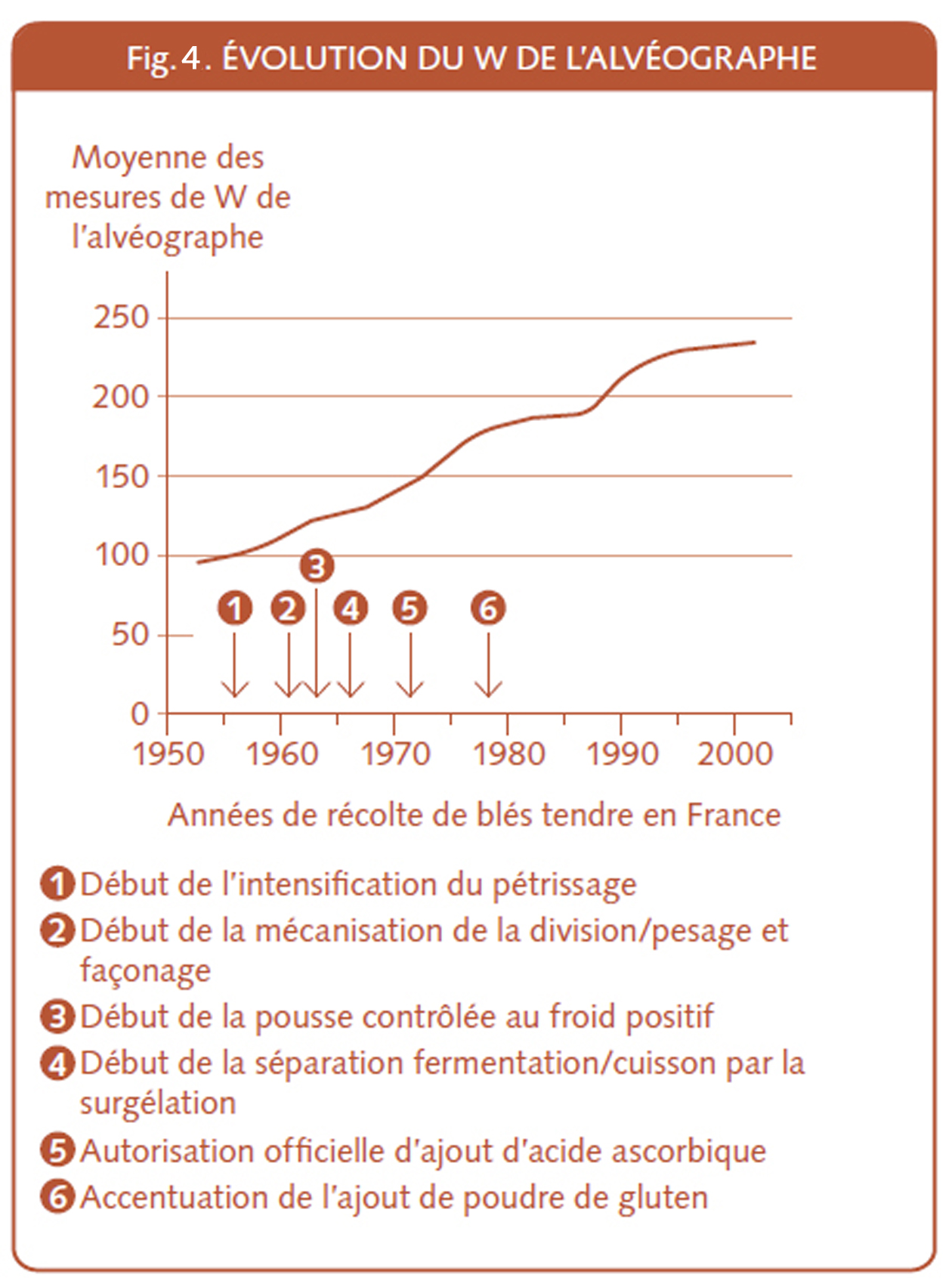 Voilà comment l’explique un consultant qui se doit d’être visionnaire et qui a planché sur la problématique dans les années 1980 : « L’accroissement de la demande en gluten par les branches utilisatrices, notamment par la minoterie et par la boulangerie industrielle, s’est fait en raison non seulement du développement de la consommation de pains spéciaux, mais aussi du renforcement des exigences techniques pour les pains usuels[51] ».
Voilà comment l’explique un consultant qui se doit d’être visionnaire et qui a planché sur la problématique dans les années 1980 : « L’accroissement de la demande en gluten par les branches utilisatrices, notamment par la minoterie et par la boulangerie industrielle, s’est fait en raison non seulement du développement de la consommation de pains spéciaux, mais aussi du renforcement des exigences techniques pour les pains usuels[51] ».
La production de poudre de gluten vital est passée de 20 000 tonnes à 270 000 tonnes sur 10 ans de 1980 à 1990[52]. Et les importations de gluten en France sont passées de 596 tonnes en 1973 à 18 503 tonnes douze ans plus tard[53]. C’est aussi pour une bonne part dû à l’abandon d’importations de blés de force venant du Canada et du Nord des états-Unis. Le coût de la poudre de gluten est inférieur, grâce à la réduction en charges de transport et de par la différence de distance et de volume a commercialiser. Il existe en effet, une concurrence entre les marchés du gluten et le marché du blé de force[54] qui est nettement à l’avantage de la poudre de gluten.
La demande a également répondu à l’amélioration des pâtes de pains de farine intégrale se voulant aussi développées que le pain de mie blanche et les mixes destinés à ces pains où l’entièreté du grain figure. Une loi belge[55] donne une dérogation aux 2 % d’ajout maximum de poudre de gluten autorisé. Ce n’est toutefois, qu’en proportion d’utilisation de farine intégrale, on peut aller jusqu’à 8 % d’ajout de poudre de gluten.
La fig.4 démontre que c’est notamment les exigences techniques de l’intensification mécanique et les entrées et sorties de la surgélation qui ont exigé plus de répondant à la pâte. Soit toujours plus de gluten et même précisons, un gluten tenace qui a de la résilience (qui permet à la pâte de reprendre sa forme après une pression), un gluten qui a du ressort comme l’écrivent certaines publicités.
Même au sein de l’agriculture et de la boulangerie biologique, l’objectif gluten était bien présent. Celui que l’on surnomme parfois le père du pain bio, Raoul Lemaire[56], faisait des sélections de blé à Roye dans la Somme et puis en Maine et Loire près d’Angers. Fin des années 1960, il visait des blés à haute teneur en gluten et ira jusqu’à l’obtention du blé « A12 » ayant un W de l’alvéographe Chopin de 675, un record[57] (IX.4). Toujours pour le marché bio, à l’association Nature & Progrès, en 1982, dans le cahier des charges bio on interdisait l’ajout de poudre de gluten bio[58]. En 1988, on l’autorisa.
Le gluten, étymologiquement c’est de la colle ! Eh, oui ! Autrefois, il arrivait qu’on colle les papiers peints aux murs à l’aide de farine. Les Allemands appellent d’ailleurs le gluten, Kleberstoffe, ce qui, traduit littéralement, veut dire : substance collante. Ce n’est que dans le froment qu’on sait l’extraire par lixiviation (lavage de la pâte sous un filet d’eau), comme l’a fait dès 1745 (IX.2), le médecin de Bologne, Jacopo B. Beccari[59].
Pour les boulangers aimant les alvéoles, le gluten c’est cette matière élastique qui donne du « nerf » ou une consistance à la pâte. C’est ce que nous enseignent les cours de théorie du métier. Le pâton ne s’affaisse pas et permet de présenter une mie bien développée. Les bulles de gaz carbonique issues de la fermentation de la pâte pourront restées prisonnières de cette structure mi-solide mi-liquide et ne pas éclater grâce à l’élasticité et la viscosité du milieu pâteux qui l’entoure (XVIII.8 et XX.1).
En général, le gluten, issu du collectif des gliadines et gluténines, recouvre ± 85% des protéines du froment panifiable, qui elles, représentent environ 10 à 12 % de celui-ci. Soit sur un kilo de farine, 85 à 100 grammes[60] (VII.7). Les ± 15 % restants des protéines du froment sont dites « solubles » dans l’eau.
Ces protéines solubles, issues du collectif ; albumines et globulines, sont notamment les composantes des enzymes et sont décrites, biologiquement fonctionnelles, pour cette raison.
Ces protéines solubles[61] ont une meilleure valeur nutritionnelle – Cep (VII.7) que les protéines non solubles qui constituent le gluten.
XVI.4.6.2. Classifié toujours plus comme « machinable ».
Pour s’y retrouver dans la classification technologique des protéines du blé, un peu d’historique est nécessaire. À la suite de J.B. Beccari (1745), les protéines du blé, différenciant l’insoluble du soluble, vont se répertorier suivant le classement de Thomas Osborne (1907) qui classe toujours d’après la solubilité, mais en affinant. D’abord des protéines solubles dans l’eau, puis dans l’eau salée, puis dans l’alcool et enfin dans des solutions acides ou basiques. Actuellement le classement de Field, Shewry et Mifflin (1983) regroupe la plupart des gliadines et certaines gluténines à faible poids moléculaire sous le nom de prolamines riches en soufre et le reste des gluténines est appelé prolamines à haut poids moléculaire. Voyez les tableaux de l’évolution du classement des protéines et leurs commentaires (fig.5 de ce chapitre, fig.4 dans chap. IV.3.3 et fig.8 et 14 dans chapitre VII.7) pour pouvoir mieux saisir l’information.
En tout cas, en passant de la classification par la solubilité à la classification aux poids moléculaires (fig.7 dans IV), c’est un changement de valeur qui est entériné là. Et on peut dire aussi, que l’on s’éloigne d’une logique nutritionnelle en recherchant ces hauts poids moléculaires, plus difficiles à rendre digeste.
| La mesure du poids moléculaire porte le nom de daltons,
Nom de celui qui a découvert la « théorie atomique », le quaker, John DALTON (*1766 – † 1844). Le même chercheur anglais ayant une déficience dans la perception des couleurs donnera également son nom au daltonisme en faisant la description de cette différence dans l’appréciation des couleurs |
||||
| fig.5. Classement des protéines du froment par le poids moléculaires | ||||
| Un acide aminé = 110 daltons .
Une protéine = une liaison entre 10 à plus de 1.000 acides aminés. |
Prolamines | |||
| Albumines | Globulines | Gliadines | Gluténines | |
| De 5.000.000 à 90.000.000 daltons
(mais solubles) |
De 25.000.000 à 75.000.000 daltons | De plusieurs millions de daltons à 100.000.000 | ||
| Wikipédia sur John DALTON. DACOSTA, 1986 et POPINEAU et col.,1991, pour les poids moléculaires. | ||||
Il faut bien dire que si on ne peut contester que le gluten revêt une qualité technologique, sa proportion en quantité n’est pas toujours un critère fiable.Il faut la quantité, mais aussi la qualité.
Pour cette raison, il est rare en meunerie conventionnelle qu’une farine panifiable ne soit composée que d’une seule variété. La qualité du gluten d’une variété doit souvent être rectifiée par la qualité du gluten d’une autre variété.
C’est pourquoi les recherches de prédiction de la qualité panifiable (IX.2 à IX.4) se sont affinées en ciblant d’abord, le rapport gliadine/gluténine[62], puis par après en tenant compte de la teneur en protéines « insolubles » à hauts poids moléculaires[63]. Mais sans résultat vraiment probant, du moins pour déterminer quel type précis de protéines apportait l’élasticité désirée, ni trop tenace, ni trop extensible.
D’autres protéines, par exemple : les Pprc (abrégé de Petites Protéines Riches en Cystéine-acide aminés soufrés), les puroindolines, issues des protéines solubles, jouent sans doute un rôle déterminant, pour une bonne friabilité[64].
C’est en fait, un ensemble (protéines, pentosanes, lipides, amidon) qu’il faut estimer. Les interactions des protéines avec les lipides et les pentosanes[65] orientent aussi la recherche vers la présence nécessaire de cet ensemble, plutôt que la « préciosité » d’une seule protéine bien spécifique.
À ce niveau, la recherche sur les composants protéiques… cherche encore.
Il faut certainement interpréter la demande de « machinabilité » (fig.4) dans ces chiffres multipliés par 15 sur plus ou moins 10 ans en ce qui concerne la poudre de gluten ! Peut-on interprété cette hausse en terme de rectification de la récolte ? Ne devrait-on pas voir dans ces chiffres une demande plutôt additive que corrective, pour atteindre des performances toujours plus grandes, surtout en pain de mie et en procédé de panification différé par le froid négatif (sous 0 °C.) ?
Si l’ajout de gluten s’indique vraiment, plusieurs aspects doivent être pris en compte.
D’abord l’affinité de l’ajout de gluten vital avec le gluten natif de la farine.
Pour ce faire, le conseil du professeur Calvel est de ne pas dépasser les 2 % au kilo de farine[66]. En France et en pratique, on dépasse rarement ces 2 %[67], mais dans les mixes, mélanges meuniers pour farines boulangères, et surtout dans les mélanges prêts à l’emploi comportant beaucoup de fibres, c’est autorisé d’ajouter jusqu’à 8 % en Belgique[68]. L’aspect qualitatif au niveau technologique du gluten vital est encore plus important, d’autant que les procédés d’extraction et de séchage sont susceptibles de le dénaturer[69]. Lors de l’analyse de 41 lots différents de gluten vital, une étude mit en évidence une telle diversité qu’il y avait autant de qualités que de lots de gluten vital[70]. Cette étude a été réalisée à la demande de Gers-Farine, fin du siècle passé. Elle démontra des différences de W de l’alvéographe Chopin de 71 à 222 pour les farines reconstituées. C’est clair, il faut se montrer prudent quant à l’efficacité de la poudre de gluten vital, puisque assez logiquement si la qualité technologique des farines souffre de conditions climatiques, les glutens qui en seront extraits seront pénalisés de la même manière.
Faisant le scan de la valeur de la récolte 1994 en France dans une revue spécialisée, G. Martin dit que « malheureusement, il faut reconnaître que nous ne disposons pas encore de moyens d’investigation suffisamment précis pour expliquer la variabilité de la qualité des protéines en fonction de la récolte[71] ». Ou encore, cette mise au point établie par P. Feillet en 1999 : « les nombreux modèles qui ont pu être proposés pour expliquer le caractère viscoélastique du gluten demeurent de simples hypothèses de travail dont l’affinement méritera encore de longues études[72]. »
Finalement, dans le conventionnel, c’est le choix variétal du semis qui semble être l’indicateur le plus fiable de la qualité technologique en terme de présence et qualité du gluten dans la farine de froment, déclarée alors panifiable.
Les Variétés de froments Recommandés par la Meunerie française (Vrm) sont classées successivement en Bpf (Blé Panifiable de Force), Bps (Blé Panifiable Supérieur), Bpc (Blé Panifiable Courant) et Bau (Blé pour Autres Usages), notamment fourrager (III.7). Et c’est a souligner avec, théoriquement compensation financière pour l’agriculteur, puisqu’un blé de force est moins rentable à l’hectare (moins 20 à 30%). Ce qui implique pour les blés de force et supérieurs, un incitant financier à l’achat auprès de l’agriculteur.
Le choix de la date du semis et la culture peut influer aussi. Par exemple, si c’est du froment de printemps, il contient plus facilement du gluten que le froment d’hiver. Les froments canadiens (Cwrs, Canadian Western Red Spring), parmi les plus réputés des froments de force ou froments améliorants, sont des froments de printemps puisque le climat canadien ne supporte que ceux-là (III.3).
Il faut aussi que la méthode de culture soit bien adaptée à la variété. « Il est démontré maintenant que l’expression de la valeur d’utilisation génétiquement programmée d’une variété dépend des conditions de culture[73] ».
Une autre observation, est de remarquer que la région doit être bien appropriée à la variété.
Par exemple dans les variétés de printemps dites de force (Bpf à très forte teneur en gluten), les variétés Prinqual et Florence-Aurore, existant en France, donnent clairement de moins bons résultats au Nord qu’au Sud. Le Sud-Est de la France est la provenance de 90 % de ce type de collecte de blés de force en France. Principale défaillance du Nord de la France, une plus grande sensibilité à la germination sur pied de ces variétés et un manque d’ensoleillement.
Et encore, il faut voir si la saison a été propice au bon moment. Pour chaque stade de la culture du blé, un temps idéal est indiqué, mais il n’est évidemment pas toujours au rendez-vous au niveau météo (V.9), c’est le lot de chaque culture, chaque récolte, chaque année.
Après le constat de l’état de la récolte, le meunier apportera son professionnalisme par le mélange de variétés en recherchant la complémentarité entre elles (fig.6).
Par exemple, la variété de froment Soissons (médium hard), fort dominante dans les cultures françaises de 1990 à 2000 (III.14 et VII.7), impliqua l’obligation de la travailler en mélange au niveau de la meunerie parce qu’elle engendrait des difficultés de lissage de pâte en boulangerie. La raison est qu’elle comporte beaucoup de Hpm (protéines de haut poids moléculaires). Ce qui semble bien une option de la sélection.
| fig.6. Profil d’aptitude technologique des variétés de froment cultivées en 2007,
afin d’opérer les bons mélanges. Une variété pouvant rectifier l’autre. |
|||||||
| Variété | Hydratation au pétrissage | Collant au pétrissage | Allongement au façonnage | Élasticité au façonnage | Développement | Volume | Note totale |
| Caphorn | Très bonne | Bon | Très mauvais | Moyenne | Très moyen | Très bon | Moyenne |
| Apache | Mauvaise | Bon | Bon | Bon | Bon | Bon | Bonne |
| Sankara | Moyenne | Moyen | Moyen | Très moyenne | Très mauvais | Très moyen | Très mauvaise |
| Soissons | Bonne | Bon | Mauvais | Moyenne | Très moyen | Bon | Très moyenne |
| Mendel | Moyenne | Bon | Bon | Très moyenne | Bon | Moyen | Bonne |
| Isengrain | Mauvaise | Bon | Très mauvais | Moyenne | Très mauvais | Très moyen | Très moyenne |
| Aubusson | Mauvaise | Bon | Bon | Bon | Bon | Bon | Bonne |
| Rosario | Moyenne | Bon | Mauvais | Très moyenne | Très mauvais | Très moyen | Très mauvaise |
| D’après MéLEARD, 2008. | |||||||
XVI.4.6.3. Qualité technologique versus qualité nutritionnelle.
Mais jusqu’où ira-t-on dans ce chemin vers du froment aux protéines toujours plus compactes et dense, de haut poids moléculaires, des pâtes issues de ce grain toujours plus riches en ténacité (qu’il faudra même modérer avec des adjuvants, XVI.7), des protéines toujours plus lourdes, des croûtes et mies toujours plus élastiques lors du rassissement ?
N’est-on pas en train d’assurer de trop sur ce point, considéré comme étant un des premiers détectés et un des meilleurs critères de qualité technologique pour le froment. Mais il n’est pas le seul, « …ce critère de résistance (hard) ne constitue pas le critère universel de la qualité du blé. Lui seul ne peut prédire quels seront les rendements en mouture, la force ou propriétés rhéologiques des farines et pâtes », nous signale Joël Abecassis[74].
Et puis faut-il s’excuser de penser à un critère de qualité qui ne serait pas technologique, mais nutritionnel ? Même si celui-ci va à l’encontre de cette demande croissante de gluten et par conséquent des froments résistants (hard), « Plus le grain de blé contient des protéines (variétés sélectionnées en fonction et cultivé sur fumure azotée intensive), plus leur proportion de protéines solubles est basse, car l’augmentation de la teneur globale en protéines s’opère au profit du seul gluten[75] ».
Une pondération qui fluctue dans certaines limites du à la physiologie de la plante. Il est normal que l’excédent d’apport d’azote en culture, s’il se fixe, le fera plus facilement dans les protéines de réserve. Rappel qui sera récurrent, les protéines solubles ont une meilleure valeur alimentaire que les protéines insolubles, dites de réserve.
Lors de la culture, la problématique de l’apport d’engrais azotés de type nitrate, pour procurer de l’azote végétal (les protéines), n’est pas sans conséquence.
Tout d’abord, avec les variétés anciennes de hautes tiges, cela peut conduire à la verse. Ensuite la migration des excédents d’apports de nitrates va enrichir la déjà trop forte teneur en nitrates des réserves d’eaux souterraines. Résultat, une eau de consommation qui a et surtout aura des difficultés à rester « potable » (V.1 et XIII.4).
Le « dopage » des cultures par l’intensification de la fertilisation et l’apport azoté entraine d’autres problématiques : la non-protéosynthèse de l’excédent d’apport en nitrates, les apports tardifs réalisés par programmation changeant quelque peu le rapport protéines solubles/protéines insolubles au final, la réduction de la teneur en acides aminés essentiels, etc., que nous avons développé par ailleurs (V.1 et VII.7).
Dans le domaine qui nous concerne ici, plus en termes d’ajout de gluten dans la farine, on l’a vu, on sait obtenir celui-ci par « lavage » de la farine. Le procédé une fois industrialisé est très gourmand en eau et polluant de manière organique. Le procédé Martin, utilisé le plus généralement, consomme 5 à 6 m³ d’eau par tonne de farine transformée, le procédé Batter en utilise encore plus[76]. Pour les effluents polluants, ils sont à calculer en termes de Demande de Biodisponibilité d’Oxygène (Dbo) de 20.000 mg/l. Cette pollution semble importante, même si des levures dans des bassins de décantation font merveille. Il faut tenir compte également de la concentration d’amidonneries qui « réunit » les rejets organiques en quelques points en France et en Belgique[77].
N’oublions pas, comme on le signale fin des années 1980, « l’accélération éventuelle par la mise en service de grandes unités de bioéthanol, pour lesquelles le gluten sera un coproduit important, dont l’écoulement sur le marché conditionne pour une part non négligeable la rentabilité des investissements engagés[78] » .
L’amidonnerie, productrice par voie de séparation d’une part d’amidon et d’autre part de gluten vital (XVI.4.6), est parvenue parfois à donner au céréaliculteur un incitant financier supérieur que les meuniers (deux fois plus en terme d’incitant), pour revendre ce même gluten aux mêmes meuniers[79].
Ce qui s’appelle un transfert de plus-value entre secteurs économiques.
Aujourd’hui, l’industrie productrice de bioéthanol à base de blé, demandera une culture exempte de mycotoxines ou autres reliquats toxiques afin de pouvoir fournir le « résidu gluten » en alimentaire. Il faut savoir que les protéines du blé sont non grasses, contrairement aux protéines animales souvent accompagnées de graisses. C’est à ce point qu’en industrie alimentaire, on en ajoute à certains aliments (chewing-gum, céréales du petit déjeuner, jus de fruits, etc.) pour en faire des produits plus riches en protéines donc plus complets dans leurs apports nutritifs et/ou pour leurs propriétés technologiques[80].
Autre emploi de la poudre de gluten qui commercialement ne sera pas sans conséquence économique et stratégique, c’est dans le monde externe à la boulangerie qu’on le découvre. L’utilisation du gluten existe aussi dans la cosmétique (rouge à lèvres) par exemple, les produits détergents, et bien d’autres usages. Il aide l’encre à sécher plus rapidement, à stabiliser les enzymes « gloutons » des lessives, lorsqu’il enveloppe les préparations médicamenteuses, il permet « l’effet retard[81] ». Le prix céréalier 1992 a été attribué à Nathalie Gontard pour son étude « Film et emballages comestibles et/ou biodégradables à base de protéines issues du gluten de blé ». Ce sera un des points de départ de cette recherche de l’empaquetage gluten.
XVI.4.7. Les additifs oxydo-réducteurs
Avec l’ajout des agents oxydo-réducteurs, on entre pleinement dans la catégorie des additifs alimentaires répertoriés et codifiés par le Codex Alimentarius[82] et en directives européennes[83].
En 1931, L.G. Rancoule écrit que « l’abomination des abominations que fut la guerre des gaz chimiques [1914-1918] recommence ». En effet, L.G. Rancoule dit qu’après cette guerre, le président de l’association de meunerie française (Anmf) déclare que dans la plupart des minoteries en France, on traite chimiquement les farines au moyen de gaz de chlore ou benzol dans le but de les blanchir.
L.G. Rancoule qui se veut promoteur d’un pain vivant s’en insurge. Il précise que ce sont les remoulages (XII.1 et XII.12) que l’on « asphyxie » de la sorte et que les boulangers sont ainsi obligés d’utiliser « des cadavres de farine[84] ».
Il faut dire, qu’encore après la deuxième guerre mondiale de 1940-45, l’on oxydait la farine à l’aide d’arc électrique[85] ou en injectant des gaz chlorés[86]. Le Conseil supérieur d’hygiène (français) s’était pourtant prononcé contre l’utilisation de produits chlorés en juillet 1927. Mais c’est sous couvert d’appareils à destruction des larves de mites que l’installation de tels outils est renseignée en 1943 et les traitements au gaz et à l’électricité sont parfois couplés encore après la Seconde Guerre mondiale.
C’est notamment le peroxyde de benzoyle, le trichlorure d’azote, le broxyde et le dioxyde de chlore qui sont utilisés en gaz pour la bleached flour, ou farine blanchie (XVI.6), ce qui renforce aussi le gluten par l’oxydation opérée.
Certains, menant une croisade contre ces méthodes et produits, les appelleront « produits explosifs ».
 Dans les années 1930, le professeur Lenglet, alors président de la Ligue du pain naturel, le pharmacien-colonel Bruere et Raoul Lemaire, pionner de l’agriculture bio, s’attaquèrent aux « trusts du blé » qui utilisaient des « produits explosifs dans la farine pour faire gonfler chimiquement la pâte[87] ». Les produits employés en additifs étaient à cette époque des bromate (E 924) et iodate (E 917) de potassium, refusés en 1930 et plus jamais autorisés en France en boulangerie. Le bromate fut interdit en Grande-Bretagne en 1989, au Canada en 1994, au Mexique en 2000. Aux États-Unis d’Amérique, un certain flou législatif permet son emploi vu sa disparition après cuisson, du moins si on le surdosait pas et si l’on cuisait bien le pain[88]. Suivant le C.S.E (Centre for Science and Environement) en mai 2016, 84% des pains industriels en Inde en contiendraient[89].
Dans les années 1930, le professeur Lenglet, alors président de la Ligue du pain naturel, le pharmacien-colonel Bruere et Raoul Lemaire, pionner de l’agriculture bio, s’attaquèrent aux « trusts du blé » qui utilisaient des « produits explosifs dans la farine pour faire gonfler chimiquement la pâte[87] ». Les produits employés en additifs étaient à cette époque des bromate (E 924) et iodate (E 917) de potassium, refusés en 1930 et plus jamais autorisés en France en boulangerie. Le bromate fut interdit en Grande-Bretagne en 1989, au Canada en 1994, au Mexique en 2000. Aux États-Unis d’Amérique, un certain flou législatif permet son emploi vu sa disparition après cuisson, du moins si on le surdosait pas et si l’on cuisait bien le pain[88]. Suivant le C.S.E (Centre for Science and Environement) en mai 2016, 84% des pains industriels en Inde en contiendraient[89].
Le professeur Jean Buré écrira en 1980 qu’il suffit d’ajouter une goutte d’un produit oxydo-réducteur classique, « au cours du pétrissage de la pâte pour modifier spectaculairement la courbe témoin » (de l’alvéographe Chopin – IX.4), et d’ajouter qu’« il est donc très tentant de modifier (chimiquement) les qualités des farines ».
Un autre chercheur en 2002 écrit que le bromate de potassium (fig.7) est employé depuis 1916 en panification, essentiellement pour augmenter le volume des pains, et à la date de l’écrit (2002), le bromate n’était toujours pas interdit aux états-Unis [90], même s’il n’est pas recommander en boulangerie par l’office de contrôle sanitaire (la F.D.A.), et que dans l’état de Californie, on doit le signaler[91].
L’agent oxydo-réducteur le plus employé en France est maintenant l’acide ascorbique, nous y consacreront le sous-chapitre suivant.
XVI.4.8. L’acide ascorbique, l’oxydant soit-disant vitaminique.
Dans la liste des additifs autorisés en panification, l’acide ascorbique est un des plus présents et des plus appliqués. Même en certification de boulangerie « biologique » par la Communauté Européenne, l’acide ascorbique a été autorisé[92]. Il se retrouve là dans la liste A des produits autorisés, alors qu’aucun cahier des charges privé qui précédaient la certification biologique certifiée par la C.E., avant janvier 1993, ne l’autorisait[93].
XVI.4.8.1. L’ambiguïté de son autorisation
Voyons comment l’ autorisation de l’acide ascorbique (E 300) s’est déroulée et rappelons que l’on doit classer l’acide ascorbique dans son action anti-oxydante en meunerie et oxydante en boulangerie.
Lorsque l’écrit du professeur Buré[94] fait allusion aux produits interdits en France, c’est aux bromates et iodates, qu’on vient de voir plus haut qu’il faut penser. Mais l’emploi, dit discret, de l’acide ascorbique dès les années 1930 [95] semble contourner cette interdiction des produits que nous appellerons « oxydants » et que d’autres appelaient à cette époque « procédés explosifs[96] ». Cependant, ce n’est qu’en 1933 que l’on parvient à synthétiser la vitamine C[97]. Les temps nécessaires à la mise en place des procédés de fabrication et de commercialisation qui suivront font qu’obligatoirement l’usage de l’acide ascorbique ne peut qu’être discret en ces années. L’observation du professeur Calvel de l’usage d’acide ascorbique en biscotterie révèle aussi les besoins des entreprises voulant obtenir avec assurance un pain de mie bien développé.
Alors action oxydante ou réductrice ? En effet, ce corps oxydo-réducteur à l’action réversible (redox) « est autorisé en France comme conservateur, en réalité, lorsqu’il est employé en boulangerie, le substrat est oxydé ». « On peut utiliser cet améliorant, car l’emploi de l’acide ascorbique est toléré comme réducteur, dit conservateur des produits alimentaires et de ce fait, il est autorisé à des doses massives -300 mg/kg ». Nous résumons là, avec les propos du professeur Buré, l’action oxydante.
Continuons sur la même source. « Les fabricants d’améliorants biologiques de panification ont profité de cette possibilité d’emploi et ensuite les fabricants de farine de fève ont suivi[98] ».
L’action inverse dite « réductrice » ou conservatrice est facile à expliquer avec l’exemple de la banane épluchée et tranchée. Celle-ci brunit assez vite par oxydation enzymatique au contact de l’air. Lorsque l’on applique du jus de citron sur ces morceaux de bananes tranchées, ils sont préservés et ne brunissent pas si vite, et nous avons là, l’action dite réductrice.
Les recherches sur l’application de l’acide ascorbique en panification débutèrent en France pendant la Seconde Guerre mondiale, période propice aux produits dits de substitution. C’est le 21 mai 1953 que l’autorisation française dans l’alimentaire est prise par arrêté. Seule une circulaire du 30 octobre 1972 précise les possibilités d’incorporation au stade de la meunerie[99]. Signalons que le Cnerna affirme depuis 1960 que l’autorisation concernant l’ajout d’acide ascorbique doit être étendue à la meunerie[100], tandis que le professeur Raymond Calvel dans un article intitulé « Acide ascorbique et goût du pain », souhaite que l’on en revienne comme avant 1974 à l’autorisation exclusive aux boulangers[101].
En Belgique, c’est l’arrêté royal du 2 septembre 1985 qui l’autorise pour le pain autre que le pain de ménage[102], tandis qu’un autre arrêté royal autorise la dose de 50 mg par kilo de farine de froment[103].
On peut aussi se poser la question de savoir si l’acide ascorbique est bien la vitamine C, comme on n’hésite pas à la dénommer commercialement.
D’abord, voyons les avis, pour les tenants de la vitamine naturelle.
Pour eux, c’est non ! Il est d’ailleurs scientifiquement reconnu que cet acide reconstitué par produits de synthèse (qui tient son nom du fait que la carence en vitamine C provoque le scorbut) ne peut pas à elle seule lutter contre cette maladie. Il faut que des cofacteurs naturels l’accompagnent. Et ceux-ci (les bioflavonoïdes) ne font pas partie de la vitamine C de synthèse. Les défenseurs des méthodes naturelles disent également que tout apport complémentaire de vitamine C de synthèse risque d’inactiver d’autres vitamines et se fera au détriment des autres transformations enzymatiques. L’hypervitaminose C (trop grosse dose de vitamine consommée) peut être la cause de déséquilibres, d’apparition de lithiase (calculs), de déficit de l’enzyme glucose-6-phosphate déshydrogénase (XVI.10.1), de transformations en acide oxalique, de favoriser l’acidose, de diminuer la digestibilité, etc.
Pour les tenants de la vitamine C de synthèse, l’avis sera différent.
On est pour l’apport complémentaire de vitamine C, voire même des méga-doses. Linus Pauling, deux fois prix Nobel, n’a-t-il pas écrit un livre intitulé La vitamine C, le rhume et la grippe dont la traduction française porte un titre plus accrocheur Abusez de la vitamine C, voulu par les éditeurs qui veulent des intitulés flashant au premier coup d’œil (donc absent de sens critique).
Sous sa forme naturelle, la vitamine C serait extrêmement coûteuse et impossible en application intensive. Or, aujourd’hui, on respire de l’air pollué, on boit de l’eau amenée par des tuyaux de cuivre, on consomme des aliments pollués par les nitrates, on subit plus de stress, on est parfois exposé aux rayons X et aux fumées de cigarettes, situations qui diminuent la biodisponibilité de la vitamine C, ou dont les effets négatifs sont atténués par la vitamine C.
La vitamine C naturelle est d’ailleurs déclarée par les tenants de la vitamine C synthétique comme une curiosité de laboratoire. Il y a bien longtemps que l’on ne presse plus des citrons siciliens pour l’obtenir. La synthèse de l’acide ascorbique dérive de divers hydrates de carbone et est opérée par des microorganismes génétiquement modifiés [104].
XVI.4.8.2. Divers emplois, divers dosages
Voyons quel est son emploi et son dosage en panification ? On peut aller jusqu’à 300 milligrammes (ou ppm), mais nous l’avons vu précédemment, cette dose est celle nécessaire à son effet antioxydant.
On l’a déjà observé plus haut ce n’est plus l’acide L-ascorbique qui est l’agent actif dans un mélange parfois vigoureux de farine/eau, mais son métabolite (le produit issu de sa transformation) l’acide L-déhydroascorbique.
Une fois ces effets dûment constatés, cela nous empêche d’auréoler cet acide L- déhydroascorbique du nom de vitamine C, d’autant que l’effet d’enrichissement vitaminique est pratiquement détruit lors du processus de la panification, surtout à la cuisson où on estime qu’il est détruit au moins à 80 % [105].
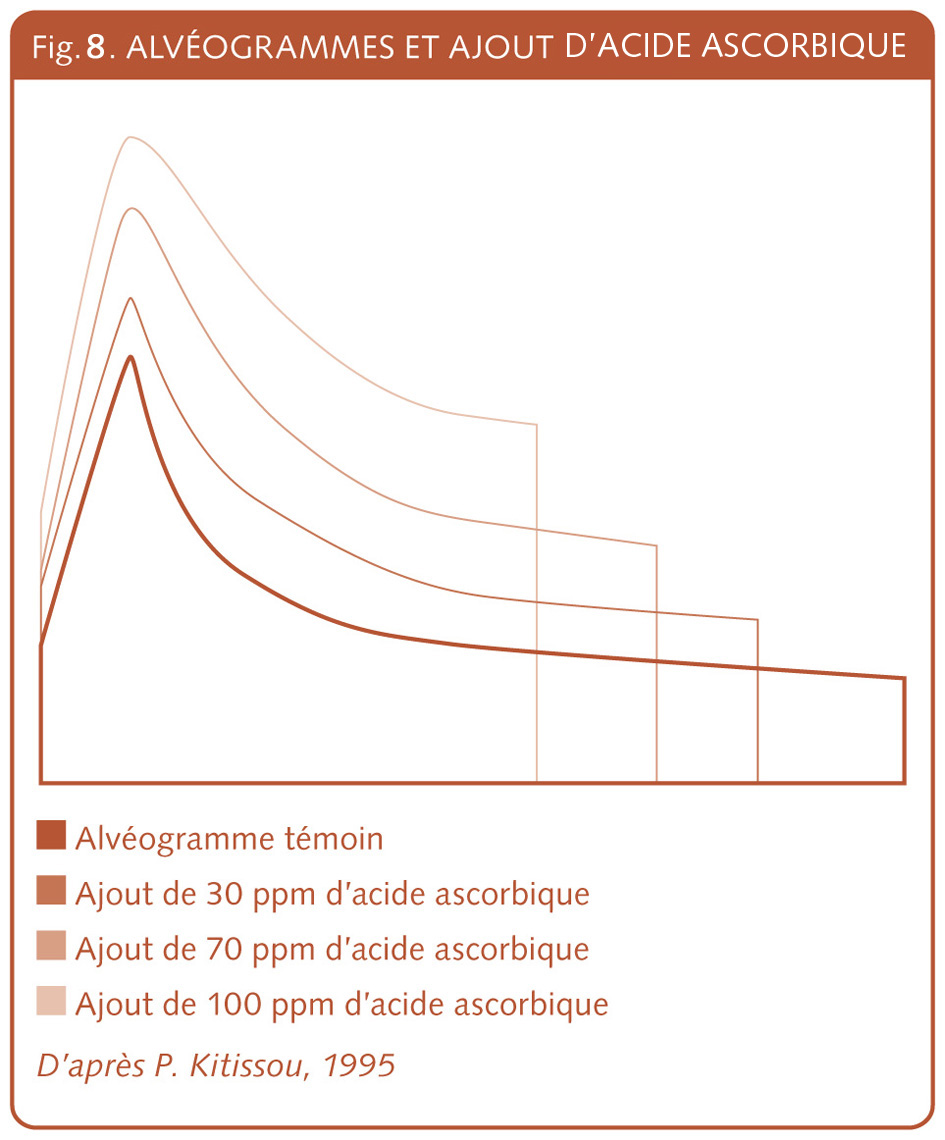
Des essais réalisés en 1974 à l’école de la meunerie française démontrent que l’on obtient déjà des résultats avec des doses de 30 à 20 fois inférieur à la dose maximale autorisée[106] (IX.4).
 Un petit calcul fait par mon ami Axel m’a permis de voir sur le marché par internet que les 10 ppm d’acide ascorbique, ajouté au kilo de farine, coûtaient 0,000056 € si ceux-ci permettent de rectifier une farine déclassée en impanifiable et achetée ne fus-ce que 0,01 € moins cher au kilo. Cela ne fait qu’un cent par kilo. Pas de quoi fouetter un chat. Mais, ajoute-t-il, pour des grands moulins qui écrasent des chiffres se comptant en million de tonnes par an, cela fait, pour ce type d’entreprise meunière, environ 10,00 € d’économie par tonnes.
Un petit calcul fait par mon ami Axel m’a permis de voir sur le marché par internet que les 10 ppm d’acide ascorbique, ajouté au kilo de farine, coûtaient 0,000056 € si ceux-ci permettent de rectifier une farine déclassée en impanifiable et achetée ne fus-ce que 0,01 € moins cher au kilo. Cela ne fait qu’un cent par kilo. Pas de quoi fouetter un chat. Mais, ajoute-t-il, pour des grands moulins qui écrasent des chiffres se comptant en million de tonnes par an, cela fait, pour ce type d’entreprise meunière, environ 10,00 € d’économie par tonnes.
Pour revenir à l’aspect technologie améliorante, quels sont les autres effets recherchés par l’ajout de l’acide ascorbique ?
En gros, c’est l’action de l’acide L-déhydroascorbique qui, au cours de la panification, permet surtout de raccourcir le processus de maturation de la pâte.
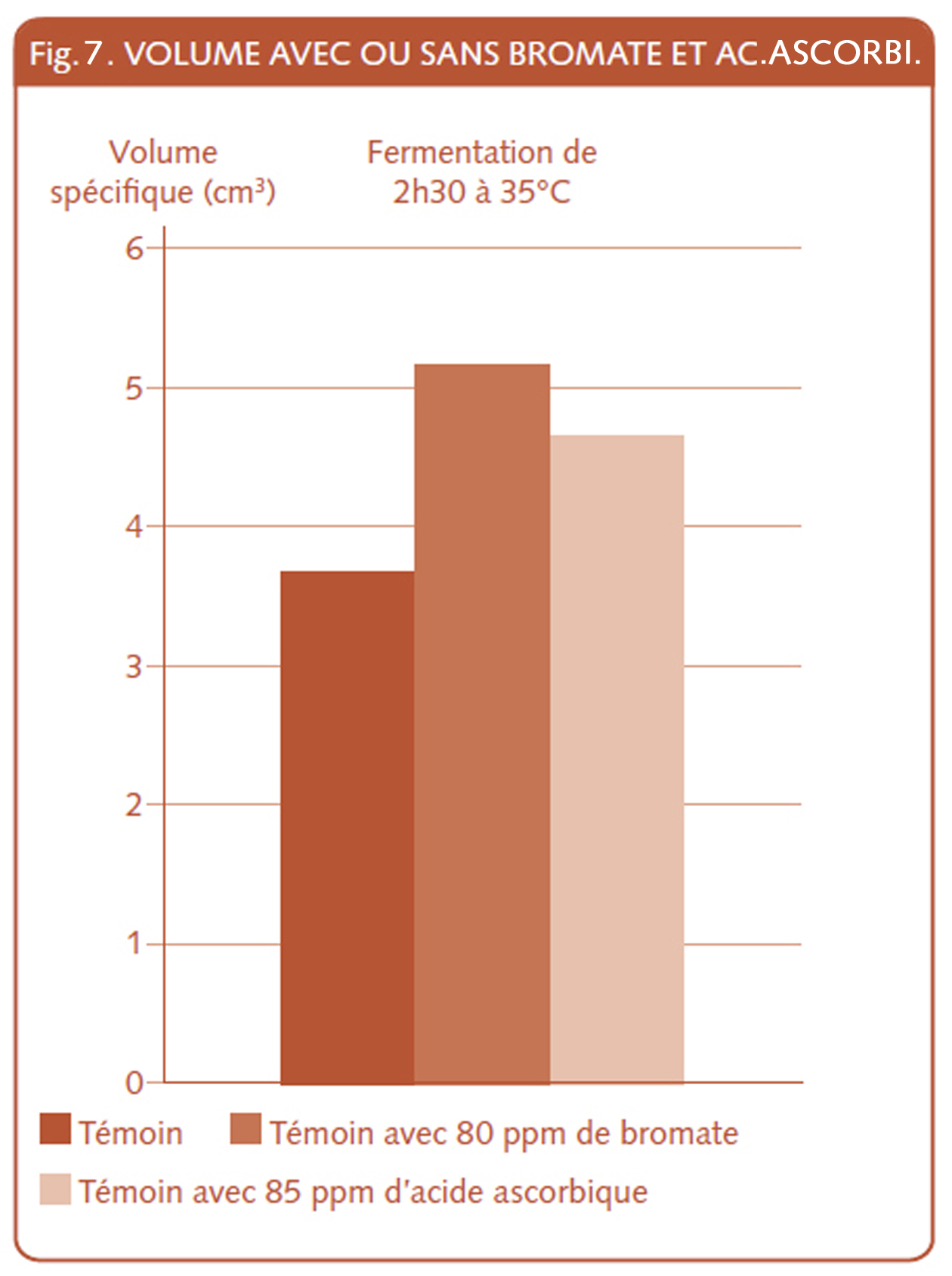
C’est cet acide ascorbique qui a rendu possible et assuré le succès du Chorleywood Bread Process (Cbp – XVI.4.5), procédé du célèbre centre de recherche anglais[107], largement employé par les boulangeries industrielles produisant des pains de mie. Des technologues français signalent que pour ce procédé, 75 ppm d’acide ascorbique et 0,7 % de matière grasse sont ajoutés et surtout, le pétrissage est intensif[108].
L’acide ascorbique aide à une rapide maturité de la pâte (qui s’obtient en oxydant celle-ci), raffermira les qualités plastiques (le gluten), son emploi s’indique surtout lors de l’usage du pétrissage intensif. Et enfin cet acide permet d’augmenter le volume, comme le réalisait le bromate (fig.8). En 1993, Hubert Chiron cite « la contribution de la boulangerie de l’Ouest aux techniques françaises de panification » et commente la période dite « pain blanc » des années 1960. Il nous permet de comprendre que le couple acide ascorbique/pétrissage intensif, ou pire, le trio acide ascorbique/farine de fève/pétrissage intensif, suroxyda ou « lessiva » les pâtes de pain blanc. Pain qui, dans les années 1950-1960, était réclamé par des consommateurs, pour qui le souvenir des bons de rationnement et des « périodes de pain noir » indiquaient clairement l’orientation à prendre.
Dans cette période, on y parle du passage du pain de 4 livres au poids de 3 livres en France[109]. Cette augmentation de volume opérée par l’ajout d’acide ascorbique masquera les baisses de poids de pains.
On parle aussi de baisse de poids des petits pains (pistolets en Belgique). On retrouve la même réflexion dans un fascicule publicitaire belge de 1973. Là, on rend hommage à un représentant d’une firme d’améliorant, lors de sa mise à la retraite, en signalant sa force de persuasion. Puisqu’il parvint à faire comprendre à l’exposition universelle de Bruxelles en 1958 à « bon nombre de boulangers de ne peser que 1 500 grammes pour les [la balle de pâte de 30] sandwiches au lieu des 2 000 grammes[110] ». Le tout se passant également avec la même apparence au niveau volume et une réduction au niveau du poids du pâton. Notons que pour le pistolet belge à la mie fortement expansée, celui-ci recevra des qualificatifs, de « petite chose molle et cartonneuse » dont le procédé de production « s’enraya sévèrement dans les années 1980 »[111].
C’est ce qui a impliqué également les dispositions prises par la loi belge afin d’éviter les fraudes sur la dénomination faisant passer les pains boulots (de formes allongées vers l’ovale) pour des baguettes (le premier étant réglementé au niveau du prix, l’autre pas). La loi précisait que pour cette raison la baguette devait peser au moins 400 grammes cuite et mesurer onze centimètres aux 100 grammes[112]. Aujourd’hui, les jeunes boulangers belges qui s’installent ont du mal à comprendre cette disposition réglementaire, d’autant que le prix imposé est devenu libre depuis juillet 2004 et surtout qu’avec le même volume de pain, mais un poids moindre, on ne peut plus l’appeler baguette, mais ficelle ou flûte.
Notez que cet article de loi n’est plus tellement contrôlé et qu’il est cité ici, presque pour l’anecdote.
N’empêche qu’avec la baisse du poids du pâton et réduction du temps de travail on arrive au point de lire dans une revue publicitaire, un article dont le titre est on ne peut plus clair « Un pain en 2 h. 30’ au lieu de 3 h. 30’[113] ». Voilà deux arguments, qui par les avantages financiers qu’ils génèrent, font qu’il est bien difficile de porter un regard critique sur cette évolution de la boulangerie qui restera un métier marqué de pénibilité.
Toutefois, professionnellement, la critique ne semble pas inutile à être posée. Tout d’abord, parce que la multiplication des nouveautés (évolution des pétrins et usage d’adjuvants) et les informations plus publicitaires qu’objectives font que la maîtrise technologique exige une plus grande dose de connaissances et compétences. Or quel est le boulanger qui peut prétendre calculer l’effet de l’ajout d’acide ascorbique ? Il faudrait qu’il puisse savoir que la farine qu’il emploie contient cet acide et que celui-ci oxyde la pâte, ce qui n’est pas enseigné. Ce qui implique une révision des « cursus » des cours de théorie professionnelle[114].
L’ajout est indiqué sur le sac de farine. Ce qui est malheureusement plus rarement noté sur l’emballage de l’adjuvant, qui se contente souvent de décrire les avantages de celui-ci. Ensuite la quantité d’acide ascorbique n’est, elle, pratiquement jamais indiquée. Il est vrai que le secteur meunier a très fort souffert de la baisse de la consommation du pain et son outil est largement sous-employé.
La meunerie n’a pas pu dans cet état contraignant laisser s’échapper des pratiques commerciales aussi intéressantes que l’emploi de l’acide ascorbique au seul secteur des fabricants d’adjuvants de panification. Depuis 1993, une des plus grandes meuneries belges proposait à sa clientèle boulangère une gamme de parfois 20 sortes de farine « neutre ». Seule, une des ces farines « neutres » est était exempte de tout ajout. Mais on ne garantit que 10 % de protéines sur cette farine. On voudrait affaiblir la vente de ce type de farine qu’on n’agirait pas autrement. Signalons pour l’objectivité que si notre analyse s’exprimait sur une des plus grandes meuneries belges, c’est parce que celle-ci a plus de transparence que d’autres dans l’étiquetage.
L’indication de la quantité d’additifs dans l’adjuvant ou la farine, n’est malheureusement pas renseignée. à la décharge des firmes indiquons que la formulation de certains additifs ou correctifs ne peut se faire que lors de l’évaluation de la récolte. Ainsi la firme d’adjuvants Puratos déclarait début 1977 dans sa revue publicitaire « Entre-nous », que l’améliorant T 500 en était à la formule n° 853, tant l’évolution technologique et l’évaluation des « crus » de céréales entraînaient des adaptations et des doses différentes.
Pourtant le professeur Calvel[115] signale qu’au Japon, les doses d’additifs sont toujours indiquées sur l’emballage.
On n’est pas étonné, en lisant ce qui précède, que lors des discussions amenant à l’élaboration du décret français pour le pain de tradition en 1993 excluant l’acide ascorbique, Guy Boulet fort impliqué dans sa rédaction et sa reconnaissance confie à Steven Kaplan, les pressions exercées par un « lobby de la Vitamine C[116] ».
Trop de ténacité qui rend la croute gommeuse ou un écaillage excessif de celle-ci après ressuage, voilà des dérives déjà constatées dans l’influence du surdosage d’acide ascorbique ou d’autres agents oxydants dans la farine.
XVI.4.8.3. Autorisé en bio, interdit en tradition
Voilà pour l’aspect technique, pour l’aspect légal, observons par exemple qu’en Belgique le texte de loi de 1985 relatif aux adjuvants pour produits à base de farine précise point 4.1. que doit figurer dans l’étiquetage « un mode d’emploi rédigé de façon telle que l’utilisation conforme de l’adjuvant n’apporte pas dans le produit à base de farine, une teneur en ingrédients ou additifs supérieure a ce qui est autorisé par le règlement en vigueur[117] » , ce qui est interprétable à souhait.
En 2003, dix ans après le décret pain de tradition qui a interdit son ajout, des chercheurs posent clairement la question « L’acide ascorbique est-il un additif ? ». Les auteurs nous précisent que les doses au kilo de farine augmentent suivant les processus, en panification en direct (20 à 60 ppm), au processus mettant en jeu la congélation (150 à 200 ppm), en passant par les processus de pousse lente (60 à 80 ppm) et de blocage au froid positif à 2 °C (80 à 100 ppm). Dans les conclusions, les chercheurs se demandent si l’on ne doit pas accepter « l’auréole » de vitamine C, pour que l’acide ascorbique prenne le statut d’auxiliaire technologique[118].
Par sa disparition assez importante à la cuisson, on ne peut dispenser l’action de l’acide L-ascorbique du manque de publicité sur l’emballage puisqu’il n’est pas utilisé en « raison de sa propriété vitaminique[119] ».
Dans la réalité, l’usage de l’acide ascorbique en panification prouve à souhait :
- Le manque de transparence des firmes « para-boulangères » et aussi parfois le peu de clarté des textes légaux. Ajoutons que déontologiquement, on ne peut appeler un élément « vitamine » que si cet élément est indispensable du point de vue général aux besoins de l’organisme, ce qui dans le cas qui nous occupe n’a pas lieu, du fait de la destruction de la vitamine C à la cuisson.
- Le cumul des doses insérées dans la farine et l’adjuvant.
- L’emploi possible d’autres adjuvants oxydants dans les pains spéciaux.
- L’usage d’un pétrissage intensif, suroxydant.
- Le surdosage de levures et ainsi de fermentation trop oxydante.
- La possibilité du boulanger qui employait à l’époque l’ajout d’une « pilule » de vitamine C au pétrissage, d’où parfois cette ancienne expression de « pain à la pilule ».
Tout cela additionné organise plus une dérive technologique qu’une compétence professionnelle.
Et puis justement, professionnellement, posons-nous la question, quelle est la place de l’acide ascorbique dans une panification naturelle (I.4) ?
Tout d’abord, signalons que les actes législatifs posés par les fonctionnaires représentant les états membres de la CE pour rédiger l’annexe de la directive européenne bio 2092/91 ne se sont pas fait en étudiant la réglementation produit alimentaire par produit alimentaire (de manière dite verticale), mais par ingrédients ajoutés (de manière dite horizontale). Ce qui handicape la critique portée spécifiquement sur l’acide ascorbique en panification dite biologique, puisque nous l’avons vu son rôle en boulangerie est à l’opposé de l’action d’agent anti-oxydant dans laquelle la classification du code européen des additifs le classe ; acide ascorbique et ses sels, soit E 300 à E 303.
Deuxième observation, plus pour les boulangers se revendiquant de la panification « biologique ». Ceux-ci visent généralement à favoriser l’activité biologique de la pâte, ce qui leur permet d’essayer d’éviter l’emploi d’additifs et de privilégier le recours aux méthodes de panification naturelle (par exemple ; fermentation au levain naturel, autolyse de la pâte, respect des temps de fermentation, pétrissage lent, etc.). Méthodes de panifications naturelles qui seront de la sorte approfondies et non laissées pour compte.
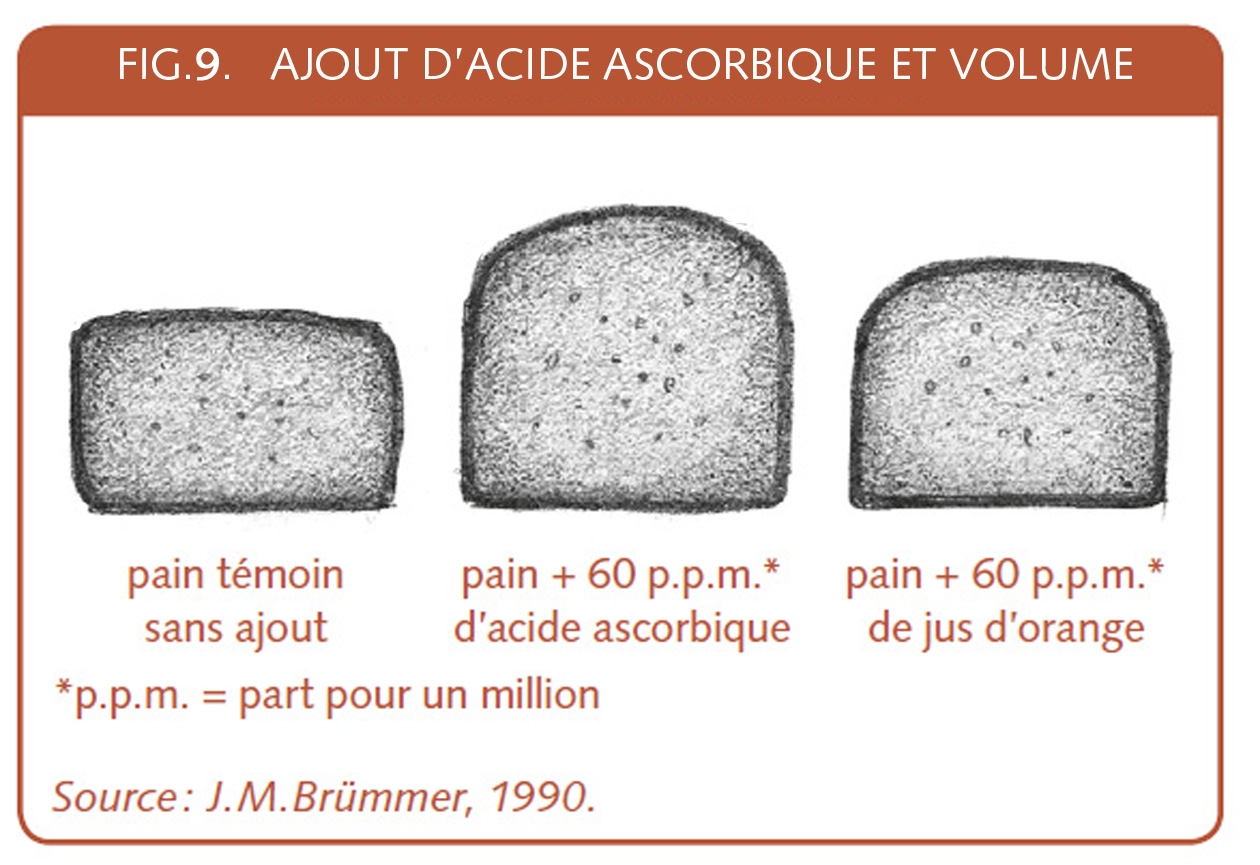 Troisième remarque, il ne suffit pas de dire que l’acide ascorbique est un produit de synthèse pour récuser sa présence en technique de panification naturelle voulue notamment par les boulangers bio.
Troisième remarque, il ne suffit pas de dire que l’acide ascorbique est un produit de synthèse pour récuser sa présence en technique de panification naturelle voulue notamment par les boulangers bio.
On peut tout aussi bien ajouter du jus d’orange issu de l’arboriculture biologique certifiée et évidement pressée à froid. L’introduire dans la pâte de farine bio contrôlée et certifiée et vous aurez à peu près le même résultat que celui de l’ajout d’acide L-ascorbique (fig.8). Des essais en Allemagne ont notamment permis de comparer l’action de ces deux types d’ajout dans un pain à la farine complète[120].
L’ajout d’acérola bio (XVI.6) peut également contourner cette critique sur la vitamine C de synthèse en boulangerie biologique.
L’ajout d’enzymes oxydantes (GOX et HOX – voir ; XVI.11.3), bien que non-natives dans la farine, voulaient contourner cet aspect législatif pour la fabrication du pain de tradition française qui ne peut comporter des additifs. Philippe Viron, de la Minoterie du même nom, à Chartres est dit « gardien du pain-patrimoine » par Steven Kaplan, il est promoteur de la baguette « Rétrodor ». En juillet 1996, il s’offusque d’une communication technique qui manifestement veut contourner la loi. Il a ces termes : « À peine ce décret sorti que des chercheurs se mobilisent afin de contourner le décret ! À quoi obéissent-ils et qui les subventionne[121] ? ».
Il me semble que la réponse qu’une panification qui se voudrait naturelle doit donner, est plus fondamentale que l’on pourrait croire à première vue.
Même « bio », même de première pression et si vous le voulez, même à froid, l’ajout de jus d’orange ou accérola bio organise une oxydation aux dépens de l’oxydation naturelle résultant de la fermentation de la pâte, qui joue un rôle bien plus bénéfique nutritionnellement et gustativement. Après avoir transcris dans la revue Les miettes de la bio de mai 1994, le dessin reprenant les essais de J.M. Brümmer, (fig.9, vu plus haut), je fus surpris d’entendre quelques collègues boulangers bio me remercier pour leur avoir refilé un tuyau pour améliorer leurs pâtes grâce au jus d’agrumes bio. J’ai même entendu : « ça marche bien ce truc-là ! ».
Pourtant pour moi, la démarche n’est pas de remplacer la vitamine C de synthèse par une vitamine C issus de l’Agriculture Biologique (A.B.), mais de favoriser la dynamique de la panification par des méthodes de fermentation naturelle.
C’est cela approfondir ses bases techniques de panification bio ou naturelle.
La réponse qu’une boulangerie se revendiquant naturelle et traditionnelle doit donner est donc plus fondamentale qu’on pourrait le penser.
L’ajout d’agent oxydant (issu de l’A.B. ou pas) a-t-il sa place dans une recherche de panification naturelle ? Voie que les consommateurs demandent et que l’on recherche lorsque l’on opte pour le « bio ».
Or l’acide ascorbique privilégie le pétrissage intensif, dès lors raccourcit les diagrammes de panification. Il privilégie aussi une maturation artificielle de la pâte aidant ainsi à réduire la fermentation, qui est l’espace goût et pré-digestif de la panification. Si l’acide ascorbique est « réducteur » en panification, c’est surtout au niveau des perspectives d’évolutions naturelles et positives de ce type de transformation de pâte en pain.
XVI.4.9. Les additifs conservateurs
Nous voici avec des additifs dont l’ajout ambitionne une meilleure conservation, vue différemment suivant les pays. On sait que plus le produit alimentaire est acide, mieux il se conservera. Le vécu des aliments lacto-fermentés traditionnels ou confits dans le vinaigre (choucroute, cornichons, et autres légumes…) permet de l’attester.
En France, avant l’application de l’harmonisation européenne de 1997, les acides lactique (E 270) et acétique (E 260) n’étaient autorisés que pour des panifications de pain de seigle ou pour des applications spéciales comme la lutte contre le pain filant (XIX.5). L’acide propionique (E 280) lui n’était autorisé que pour les pains tranchés emballés.
La Belgique avait elle, une législation de 1985 qui autorisait en plus pour les pains de seigle, l’acide citrique (E 330) et l’acide sorbique (E 200).
En Allemagne, pays de pain de seigle intégral, compact et vendu tranché, en plus de tous les acides prénommés ci-avant, les acides succinique (E 363), malique (E 296), tartrique (E 334), fumarique (E 297) et gluconique (E 640) étaient autorisés en quantité non limitée, sauf l’acide sorbique (E 200) qui avait le seuil de 2 gr/Kg à ne pas dépasser[122].
On voit par ce petit inventaire, la France a toujours eu la réglementation la plus restrictive au niveau des additifs et on voit aussi que le pain de seigle intégral (qui contient plus d’humidité que le froment) implique plus d’artifices (ici acidifiants) pour pouvoir se panifier valablement et se conserver longtemps, surtout s’il est tranché et emballé.
La dose d’acide lactique et acétique autorisée en Belgique (respectivement 10 et 5 gr/Kg. de farine) est pratiquement la dose que produit un ferment comme le levain de panification lorsqu’il est employé en pré-pâte et sans ajout de levure.
C’est ce qui incitera le centre de recherche allemand de Detmold basé en Westphalie de relancer le sauerteig, soit, littéralement, pâte acide ou professionnellement, levain en français.
Cela permit d’effacer la longue liste d’agents conservateurs qui devaient être imprimés sur l’étiquette et de remplacer celle-ci par l’inscription ; natursauerteig, soit, levain naturel. Une manière plus noble professionnellement de produire un effet conservateur.
Un petit côté humoristique peut se révéler, lorsqu’on relate que l’acide propionique se retrouve non seulement dans des fromages à pâte dure comme le Gruyère et le Comté, mais aussi dans la transpiration humaine. Et comme on parle de 200 g de sueur produite par pétrissée manuelle[123], quelque part, on pouvait à l’époque des pétrissages manuels intensifs la produire soi-même autrefois ;-).
XVI.4.10. Les améliorants composés.
Les compositions liquides, pâteuses, sèches où se mélangent les divers ingrédients, additifs et auxiliaires technologiques seront parfois la force des firmes se situant entre le secteur meunier et le secteur boulanger.
Dans ce cas, ils seront appropriés pour chaque type de panification : baguettes, pistolets, pains de mie, pains complets, … ou parfois pour des applications (congélation, pointage en bac à froid, etc.).
Ici, si la liste des ingrédients figure souvent sur l’emballage, les doses de ces ingrédients sont généralement absentes.
XVI.4.11. Les pré-mixes et mixes
Le pré-mixe est à mélanger à 50% (plus ou moins) avec la farine, quand aux mixes, ils sont à utiliser à 100 %. Ces mélanges (mixes) sont composés des améliorants en adéquation du type de pain souhaité. Ils se déclarent dans leurs publicités « être prêts à l’emploi », « …seuls la levure, l’eau et le sel sont à ajouter ». Ils font souvent appel à des suppléances artificielles pour compenser le manque de temps de fermentation appliqué qui pourtant est générateur de goût.
Ainsi, levain désactivé et farine de malt toastée figurent de plus en plus régulièrement sur étiquette, ce que nous verrons plus loin (XVI.6).
Des graines (sésame, pavot, lin, tournesol, etc.) sont parfois ajoutées également.
Et puis, un plan marketing est parfois proposé par le moulin ou la firme d’améliorants, en termes de Plv (Publicité sur le Lieu de Vente) ou soutien par opérations médiatiques.
Des aspects santé sont parfois développés en formulation ; plus de fibres, d’oméga 6, de vitamines, une teneur en sel réduite ou rectifiée, etc.
Avouons que dans ce cas, en compétence professionnelle boulangère, on délègue pas mal.
XVI.5. Les choix stratégiques d’amélioration de la panification.
Maintenant que vous voilà instruit, quelle stratégie adopter pour l’amélioration de votre panification ?
Cela dépend, bien entendu, de votre exigence vis-à-vis de vous-même et de vos collaborateurs, de votre amour du métier, de votre compétence professionnelle, de votre éthique.
Ou le boulanger se laisse prendre par l’argumentation publicitaire qui considère que vous pouvez « gagner du temps » (le temps c’est de l’argent) et tant qu’on y est les « produits surgelés peuvent vous aider pour cela », à vous de voir !
Un dirigeant de firmes para-boulangère présente les « améliorants » comme des «convenience products», (ces produits axés sur une facilité d’utilisation maximum) [124].
C’est clair, ces « produits de confort » peuvent vous proposer la rapidité et l’assurance d’une certaine « réussite » au niveau volume et cela sera de plus en plus élaboré en amont de votre production (du mix, jusqu’au précuit).
On peut également remarquer que ces produits adjuvants ou farines prêtes à l’emploi visent la rapidité de maturation des pâtes, la garantie de volume maximum, l’adaptation au processus fortement mécanisé, voir intensif. Cela fait partie d’une demande de texture maîtrisée et reproductible, plus propre au secteur industriel, qui en panification, diffèrera de plus en plus la cuisson par la surgélation.
Signalons que dans un monde qui au xxie siècle, doit se positionner vis-à-vis du manque de ressources en énergie, la cuisson différée par la surgélation représente une ineptie à ce niveau (XXI.2) par le besoin de refroidir les ingrédients de la pâte, de maintenir la production au froid négatif, lors du stockage, de la livraison et de l’entreposage au lieu de vente. D’ensuite devoir dépenser une énergie supplémentaire afin de passer du froid à la cuisson. Le professeur Raymond Calvel le mentionnait déjà en 1988 alors que l’acuité de recherche d’économie d’énergie ne s’imposait pas comme aujourd’hui[125].
C’est un débat qui ressurgira lors de l’avènement du décret pain de tradition française en 1993 en France, se voulant de distinguer les boulangeries traditionnelles, des terminaux de cuisson, en refusant la congélation. Ce sentant ciblé, un industriel du secteur écrira dans un article titré « Le décret pain, et si tout n’avait pas été dit… ». Puisque pour lui « l’exigence première des consommateurs vis-à-vis du pain, [est] la fraîcheur. Or ceux qui ont résolu le problème sont pour la plupart des terminaux de cuisson[126] ». Oui mais, en doublant sa consommation d’énergie et en supplémentant pas mal les procédés avec des « améliorants » texturants.
Si une migration vers une « naturalité » s’impose ces dernières années dans le secteur des fournisseurs de matières premières pour boulangeries, elle n’a pas changé ces objectifs.
Ce déplacement de l’additif à l’enzyme s’est sournoisement muté du fournil à la meunerie, et parfois de l’effet dit « améliorant » à l’effet dit « correcteur ».
C’est dans la farine et au moulin que le cocktail d’enzymes est ajouté, ce qui est différent du geste du boulanger qui ajoutait et dosait son « améliorant ».
De plus le cocktail d’enzymes participe aux mêmes fonctions oxydantes, émulsifiantes et accélératrices de la fermentation qui étaient l’apanage des « améliorants », rien n’a changé à ce niveau.
Par la formulation enzymatique introduite de cette manière, la migration du savoir-faire risque de s’opérer du fournil d’essai du moulin pour l’ensemble des clients boulangers de celui-ci.
Mais les boulangers doivent aussi avouer, que si les meuniers répondent à leurs acheteurs-boulangers leur demandant une farine « infaillible » quelle que soit la saison, quel que soit le lieu de production, il ne faut pas s’étonner dès lors que la proposition de la meunerie prenne parfois ces formules « améliorantes » et « confortables ».
« Il n’y a pas de mauvaises farines, il n’y a que de mauvais boulangers ». Ce propos très dur et difficile à assumer technologiquement peut se constater lorsque des boulangers utilisent des farines de l’agriculture régionale ayant subi par exemple, un accident climatique de blé germé sur pied.
L’adaptation de la boulangerie artisanale (surtout celle pratiquant la fermentation au levain) aux farines fluctuantes suivant les récoltes va jusqu’à confondre les critères de farine déclarées « panifiables » élaborées pour des processus industriels fortement mécanisés.
Confessons aussi que si l’entreprise meunière répond à cette sollicitation de farines infaillibles qui est majoritaire, la requête se dénommera de manière assez compréhensible ; régulatrice ou corrective, mais dans quel objectif ? Rapide ou lent, respectant l’espace fermentation ou pas ?
Le professionnel qui prendra le temps de connaître les effets technologiques des ajouts qu’il opère ou choisit, sauvegardera mieux son savoir-faire, il saura éviter les doses excessives ou encore mieux, les remplacer par des méthodes de panifications naturelles dont il lui faudra comprendre le plus précisément possible les effets technologiques et les traduire en application.
Le froid positif est devenu depuis peu un élément modérateur de fermentation et apporte quelques aspects positifs, non seulement au niveau organisationnel, puisqu’il permet aussi d’élargir l’espace-temps, élaborateur d’arômes (XVII.6.), du moins quand il ne s’agit pas de blocage de fermentation à moins de 4°C.
Dernière évolution technologique dans les équipements, la diviseuse-formeuse (XVIII.4) qui après un pointage en bac de la pâte, respecte cet espace fermentation en endommageant le moins possible l’alvéolage de la pâte et évitant le dégazage et l’évacuation d’arômes issus de la fermentation.
L’amélioration de la panification n’est certainement pas que la rapidité (rentabilité) de fabrication.
Mais, peut-être que le principale aveu est, que ce n’est pas tant l’amélioration de la panification que les conditions économiques dans lesquelles elle doit se pratiquer qui poussent à la rapidité d’exécution, (II.15). Il est très difficile de s’extraire du contexte social, il n’existe qu’un marché de l’emploi qui s’est largement modifié ces dernières décennies. La formation en apprentissage s’est déplacée vers une formation plus hors du terrain vers une formation en école technique et pas assez en alternance où entreprise et école se mélangent, ainsi que théorie et pratique.
Le contexte barémique salarial n’a pas su se faire valoriser par rapport aux salaires d’autres secteurs d’activités tertiaires (les services).
Il est aussi difficile de s’extraire du contexte fiscal, le forfait fiscal des boulangers belges est avantageux en fonction du rendement que l’on tire de la matière première mise en œuvre. En Belgique, la taxation forfaitaire, forme simplifiée de calcul d’impôt sur base de coefficient en partant du prix de la matière première, ne peut s’appliquer qu’à des entreprises au chiffre d’affaires plafonné à un certain montant (750 000,00 euros par an) et n’étant pas en société. Ce forfait fiscal belge, qui risque de disparaître[127], implique des décisions d’ajustements réguliers pris entre l’administration et la commission fiscale de la fédération des boulangers. Notamment les ajustements à appliquer à ces nouveaux produits de plus en plus élaborés en amont de la vente (pré-mixes et produits surgelés).
Comme les représentants autour de la table de négociations (fisc/administration) sont les boulangers, les fabricants de matières premières de plus en plus élaborées ont voulu faire partie des interlocuteurs auprès de l’administration en créant par leurs filiales de produits finis ou pré-cuits, un droit de représentation. Ceci afin de rendre encore plus incitatif, l’emploi des leurs produits (pré-mixes et produits surgelés) au sein du forfait fiscal.
Ensuite comment s’extraire du contexte économique. Les importants marchés publics, notamment les soumissions pour les collectivités, s’attribuent généralement au plus offrant (financièrement parlant). Au point que l’expression, « un pain d’hôpital » est devenu synonyme de pain de mauvaise qualité. Un comble pour un espace où l’on est sensé soigner les patients.
Sortir du contexte médiatique demande également une démarche très volontaire pour sauvegarder son discernement. En effet, l’espace médiatique du boulanger est souvent sa boite aux lettres avec les publicités propres au secteur, ses revues ou encore les primes, cadeaux, ristournes, hameçons des commerciaux des firmes. Le marketing employé par les firmes peut prendre jusqu’à 2/3 à 3/4 du prix de vente du produit « améliorant » proposé.
Voici des propos repris de communication de firmes productrices d’ingrédients améliorants ou mixes, dont il faut savoir prendre la mesure ; « Votre savoir-faire, notre qualité ! », « Aider l’artisan, pas le remplacer ! », « Des professionnels au service de professionnels ! » « Facilitez-vous la vie ! », « Donner à vos pains, la saveur d’autrefois », « La tradition d’antan, l’avenir d’aujourd’hui », « Seuls, la levure, l’eau et le sel sont à ajouter ».
La presse professionnelle indépendante vit budgétairement plus des publicités des firmes que des cotisations de ces membres. Même une petite fédération de boulangerie voit que le montant des affiliations ne prend dans le budget (exemple de 1996) que 21 % des entrées par rapport aux publicités insérées dans la revue envoyée à ses membres.
Le libre-marché et son effet dit souvent « régulateur de marché » influence autant, si pas plus, que l’adjuvant qui se voudrait de nos jours aussi « régulateur », mais là, ils sont plutôt nivelant au plus petit dénominateur commun.
Il faut donc sortir de beaucoup de contextes, avoir une exigence au niveau connaissance des produits et des procédés de panification, pour améliorer ses bases techniques.
Un effet oxydant n’est pas que l’action d’un agent ou une enzyme oxydante. Un surdosage de ferments, un pétrissage intensif peuvent aussi amplifier l’oxydation, il faut le savoir.
L’intervention enzymatique de plus en plus induite dans la farine doit pouvoir être mieux évaluée par le boulanger. Celui-ci pose aussi des choix de panification où les enzymes réagiront différemment. Cela se passe de manière obligée et suivant les diagrammes de panification (courts ou longs) observés par les praticiens dans leurs fournils respectifs.
Le raccourcissement de l’espace fermentation n’est pas l’objectif de tous les boulangers et ce sont notamment ceux qui privilégient la longue maturation de la pâte par la fermentation plutôt que par le pétrissage intensif et l’emploi d’ajout d’agent ou enzymes oxydants qui obtiennent les meilleures cotes aux compétitions et surtout auprès de leur clientèle.
Le levain, bien maîtrisé, apporte un bouquet d’arômes plus varié que la fermentation levurée. Cette dernière avait déjà eu de meilleures lettres de noblesse en passant par l’emploi d’une pré-pâte, type poolish (XVII.1.4).
L’autolyse (XI.4) apporte ce temps qui manquait aux pentosanes de la farine afin de mieux unir les éléments farine et eau, autrement qu’en les battant longtemps et/ou intensivement.
L’apport de pré-pâte fermentée (XVII.1.5) peut compenser les « raccourcis » opérés sur le temps de pointage.
Toutes ces méthodes de panification sont « naturelles », parfois plus coûteuses en main d’œuvre, mais aussi moins onéreuses en achat de matières premières.
Ce qui est certain, elles sont une réelle recherche d’amélioration de la panification naturelle.
XVI.6. Exercice de discernement de l’étiquetage sur sacs de farine.
XVI.6.1. Lecture critique des ingrédients étiquetés sur sacs de farine
Les ingrédients énumérés dans les pages des sous-chapitres XVI.1. à XVI.11 vont nous permettent de poser un regard critique sur ce qui apparait sur nos sacs de farine et en même temps, cela permet de faire un exercice d’évaluation de nos connaissances. Commençons par nous poser cette question, sur ce que contient un sac de farine dans le marché des U.S.A. et allons après dans notre cheminement investiguer vers la France, de quoi remarquer que ce pays est resté plus respectueux d’une farine naturelle, mais que l’ouverture aux additifs pour raison de grand marché européen plutôt en recherche d’économie d’échelle et de ce fait plus industriel qu’artisanal a fait évoluer aussi « les étiquettes » dans ce pays. On finira par le marché bio et celui des marchés de niches actuellement, type blés de pays.
_______________________________________________________________________________
Le marché nord-américain est dans ceux évalués ici, celui qui voit les plus grosses parts de marché prises par des entrepreneurs plutôt industriels, sur un pain, vu ici, dit complet. Après traduction, voici les ingrédients de cette étiquette d’emballage de pain.
Farine complète, Eau, Gluten de froment, Sirop à haute teneur en fructose, Miel, Mélasse, Levure.
Contient 2% ou moins de 2 % de : son de froment, Huile de soja, , Sel, Sulfate de calcium, agents conditionneurs de pâte : -Sels de Stearoyl-Lactilate, esters de mono- et di-glycérides, Dioxyde carbone ou/et azodicarbonamide ; Farine de soja, nutriments de levure : Chlorure d’amonium, Sulfate d’amonium et/ou Phosphate de monocalcium ; Vinaigre ; Proponiate de Calcium pour la conservation ; Lactosérum ; Lécithine de soja. Contient du froment, lait et soja.
Pour la lecture critique. Il s’agit d’un pain complet des U.s.a., pas mal sucré, notamment avec du sirop extrait de maïs (Hfcs, XVI.9.2.1) comme celui intégré dans les sodas. Farine amendée pour garantir une belle texture à la pâte, grâce à des additifs. Contenant probablement un milieu dit « pré-ferments » dans le fait que l’on évite les fermentations trop longues et que l’on ajoute un liquide que l’on fait fermenter sur « le côté ». Des agents conservateurs plutôt anti-moisissures sont aussi inclus, le pain étant généralement vendu tranché.
________________________________________________________________________________
Restons aux États-Unis avec la farine « blanchie » bleached comparée à la « non-blanchie » l’unbleached.
Farine blanchie.
Blanchie chimiquement avec des produits tels que le chlore. L’alloxane, sous-produit du processus de blanchiment, provoque le diabète chez les animaux de laboratoires. La majorité des micro-nutriments est perdue dans le processus de blanchiment. La farine peut être « enrichie » de fer toxique et elle peut contenir des résidus d’au moins 15 pesticides différents.
Farine non blanchie et biologique.
Toutes les vitamines et les nutriments restent intacts. Pas de blanchiment chimique. Pas de pesticides. Pas d’additifs toxiques. Pas d’additifs ou de conservateurs chimiques. Pas « d’enrichissement ».
Ceci est un débat présent aux états-Unis d’Amérique existant depuis le début du xxe siècle avec Harvey W.Wiley, l’instigateur de la Food Drug Administration créée en 1906. C’est le blanchissement de la farine avec en plus, l’enrichissement de la farine, et comme comparatif le pain non enrichi, non blanchi et biologique. Pour tenter d’être objectif, signalons que c’est une critique diffusée par organics.org, un lobby du bio. aux États-Unis. Le blanchiment se réalise par traitement au gaz (XVI.4.7). Le gaz sert non seulement à blanchir, mais aussi à oxyder la farine (la maturation de la pâte en devient accélérée et le gluten renforcé). En plus d’être un agent de décoloration, on dit l’employer aussi comme désinfectant. Le gazage des farines a été interdit en France en 1927, mais à plusieurs reprises (années 1930 et années 1940), l’interdiction de l’usage de gaz et de benzol dans le traitement des farines a dû être rappelé aux minotiers. Il est resté d’usage dans certains pays anglo-saxons.
_______________________________________________________________________________
Voyons les farines enrichies de compléments alimentaires. Extrait d’un diapo de l’association « Initiative de l’enrichissement de la farine ».
Généralité sur l’enrichissement de la farine. Le processus d’enrichissement consiste à ajouter des vitamines et des minéraux à la farine, au stade de la mouture. Il en résulte un produit de plus haute qualité, plus nourrissant. L’addition de vitamines et minéraux se fait en général à la mouture sous forme de petites quantités dans un pré-mélange en poudre. De plus amples informations sur ces pré-mélanges se trouvent dans ce package (un diaporama). Source : http://ffinetwork.org.
L’enrichissement nutritionnel viendra pendant les périodes de difficultés d’approvisionnement d’après la deuxième guerre mondiale. Cela passera d’une politique nutritionnelle d’abord obligatoire à une politique d’incitant volontaire dans les années 1950. Ce sont principalement les carences dues au blutage (VII.9, VII.10 et XII.12), qui inciteront aux ajouts de carbonate de fer, de vitamine B de synthèse et accessoirement de carbonate calcium, qui seront les plus appliquées.
Le cocktail, supplément de synthèse cumulé au blanchissement des gaz oxydants, entraine des métabolites non souhaitables comme l’indique une communication ayant l’approche « biologique-organique ». Cette initiative d’enrichissement de la farine en micro-nutriments est plus appliquée aux Amériques, Australie, Afrique du Sud, etc.. Les brochures distribuées sur le net le sont par une association[128] (disons lobby), regroupant le privé et des organisations émanant de la F.a.o. et l’Unicef afin d’inculquer ces promotions pour l’enrichissement de la farine. Laurent, le webmaster de Boulangerie.net, me l’avait communiqué un jour et je l’avais archivé pour finalement la reprendre ici. Il existe d’autres O.n.g. de ce type, comme Micronutrient[129] et Gainhealth[130]. Pour la France, que l’on pourrait croire le pays ou le pain est le mieux préserver au niveau législatif, du moins sur le refus de l’enrichissement, un livre[131] émettra de critiques sérieuses sur l’implication de services de l’état (Ministère et services de contrôle) avec le secteur meunier concernant le programme national nutrition santé (Pnns). Ces critiques se portent sur le manque de fibres dans la farine (VII.10) qui provoque la promotion de farines blutées et favorise le choc glycémique (VII.5). Ainsi que sur la présence de lectines et acrylamides dont la toxicité est mal évaluée (XIX.5) selon les auteurs du livre.
Il est facile de comprendre pourquoi l’enrichissement est considéré comme bénéfique sur farine blanche, il faut savoir que celle-ci est carencée de 30 % en moyenne de ses vitamines par rapport à une farine intégrale et aussi privé de minéraux, moins environ 50 %, (VII.9 et VII.10). Les arguments pour « enrichir » ne manquent pas dans un diaporama émanant d’un « réseau de particuliers et d’organisations qui s’emploient à faire en sorte que l’enrichissement de la farine devienne partout la pratique ». Il s’agit ici de la Food Fortification Initiative. Il vous suffit de cliquer sur leurs noms proposés dans un moteur de recherche pour en savoir plus.
La réponse d’employer des farines naturelles moins blutées est un réponse plus simple et moins hasardeuses, n’impliquant pas l’emploi de compléments vitaminiques et sels minéraux de synthèse (XVI.4.8) pas toujours bien assimilés.
________________________________________________________________________________
Passons à des étiquetages européens et sur sacs de farine française en particulier.
Ingrédients. Farine de blé, gluten de blé, farine de blé malté torréfié, germes de blé, farine de blé malté toasté, Farine de blé malté (*), levure désactivée (*). Enzymes : Hémicellulases, Alpha-amylase. Agent de traitement de la farine : E 300. (*) = suivant les années.
Voilà une reproduction d’étiquette d’un sac d’une farine française plus que probablement pas de tradition, vu la présence de l’agent de traitement de la farine, l’E300, soit l’acide ascorbique qui est un additif et par conséquent, non autorisé en tradition française.
Elle contient trois farines de blé malté ! On pourrait s’en étonner. La farine de blé malté torréfiée, la farine de blé malté toastée et la farine de blé malté (tout-court).
Les deux premières viennent apporter un goût de malt, de torréfaction et de toastage. Ces genres de malt ne sont généralement pas des malts ayant une activité enzymatique.
C’est le troisième qui pourrait complémenter en force enzymatique suivant l’année, tout comme le fait l’alpha-amylase également contenue dans cette farine. Autres enzymes ajoutées, plus structurantes celles-là, les hémicellulases, mais quelles hémicellulases ? (XVI.10.4 et XVI.11.2).
Pour la même raison que pour la farine de blé malté « simple et active », on ajoute de la levure désactivée suivant l’état de la récolte. C’est lorsque celles-ci donnent des glutens trop tenaces, qu’il faut dès lors assouplir avec la levure désactivée (XVI.7), afin qu’au façonnage et à la cuisson, le pâton ne se rétracte pas.
________________________________________________________________________________
Les ingrédients de la farine française présentée ici ont un cocktail d’enzymes déjà plus élaboré.
Ingrédients. Farine de blé, gluten de blé, Farine de blé malté (**). Enzymes (*) : Cellulase, Transglutaminase, Xylanase, Alpha amylase, Lipase. Levure désactivée. Agent de traitement de la farine : E 300
L’étiquette est extraite de l’émission, « Le pain est-il dans le pétrin ? » de France 5 du 19-02-2017. Par rapport aux autres étiquetages, on retrouve dans les enzymes ajoutés, les classiques alpha-amylase et xylanase parfois dites hémicellulase.
La cellulase est là pour faire bénéficier des apports de cellulose, absorbant un peu en éponge, l’eau et pour dégrader leurs contenants en bio nutriments.
La transglutaminase est ici annoncée, ce qui est rare. On verra plus loin (XVI.12) qu’elle permet des liaisons entre les chaînes de protéines et aussi entre celles-ci et les chaines de pentosanes ou hémicellulose. Il s’agit d’enzymes liantes, beaucoup employées en boucherie-charcuterie ou poissonnerie, pour assembler des morceaux en surimi ou reconstitution de steak ou de jambon par exemple[132].
La lipase peut laisser deviner qu’il s’agit d’une farine assez complète contenant les matières grasses du germe et/ou de la couche d’aleurone, puisqu’aucun ajout de matières grasses n’est mentionné. A moins que l’emploi de cette farine soit destinée aux pâtes à brioche riche en matière grasse.
_________________________________________________________________________________
Cet étiquetage de farine se destine au marché bio.
Ingrédients. Farine de blé T 65(*), farine de blé malté (*), extrait d’acerola (*), complexe enzymatique (*) : hémicellulase et alpha amylase (**)
(*) = Issu de l’agriculture biologique ; (**) = Les enzymes sont des auxiliaires technologiques et ne doivent pas être déclarés dans les produits cuits.
L’extrait d’acérola renseigné est issu d’un fruit aussi dénommé « cerise antillaise » contenant de la vitamine C (E 300 ou acide ascorbique naturel), comme le citron ou l’orange. Mais l’acérola (cultivé en bio ici) contient vingt fois plus de vitamine C que l’orange.
Le complexe enzymatique est composé d’hémicellulases et d’alpha-amylases en signalant bien sur l’étiquetage qu’il s’agit d’auxiliaires technologiques (processing aid en anglais) ne devant pas être déclarés dans le produit puisque censés disparaitre dans le produit fini. On gomme ainsi les inscriptions E… de l’étiquette qu’un additif à action similaire devrait afficher. Ici, c’est la législation sur la transformation bio qui doit être prise en compte. Or en bio, on ne peut pas utiliser des enzymes « recombinées », c’est à dire produites en fermenteur par des microorganismes génétiquement modifiés. Ce point est-il contrôlé par les organismes certificateurs bio qui se disent parfois en mal de traçabilité[133]. En tout cas, il est bien rare de voir sur le marché des hémicellulases qui ne soient pas produites par des microorganismes non modifiés puisque la production est nettement plus efficiente en multipliant dans le matériel génétique d’un microorganisme, le gène qui produit l’enzyme (XVI.8).
________________________________________________________________________________
Voici une analyse de la publicité obligatoire inscrite sur les sacs et fiches techniques avec le mix de farine Pantique avec un ®, commercialisé par une firme d’ingrédients pour boulangerie.
MIX 50%. (soit mélangé à 50 % de farine de blé).
Grains complets anciens (épeautre, amidonnier, engrain). Farine de froment complet, morceaux de lupin, flocons d’avoine, graines de sésame, farine maltée d’orge sec, graines de tournesol, graines de lin, sel de mer, sucres, fibres végétales, huiles végétales, graisse végétales, millet, levain sec d’épeautre complet, enzymes. Agent de traitement de la farine (acide ascorbique)
C’est clairement indiqué, c’est un mix à doser à 50 % dans votre mélange de farine.
Il a été sorti, déjà dans la première décade de ce siècle et aujourd’hui on le retrouve également en emballage d’un kilo pour pain ménager et machine à pain.
De quoi craindre que cette machine à pain familiale fasse le même pain que le boulanger se faisant livrer la même farine et utilisant le même procédé.
Je l’avais acheté par curiosité pour une analyse d’achat, puisqu’il m’arrivait de panifier des céréales anciennes,…mais pas comme cela.
Afin de ne pas gâcher ce mixe, et avant de le déclasser du stock, mon collègue de travail poussa la curiosité plus loin en le panifiant pour lui-même. Comme il n’avait jamais employé de mixe, il l’avait utilisé pur et resalé…
Ces 50 %, qu’il ne faut donc pas resaler, contiennent de l’engrain, de l’amidonnier et de l’épeautre en grains, ou plutôt en éclats de grains. On doit les voir et les croquer. Les farines, elles, sont dites complètes de seigle et de froment. Dans les autres ingrédients, millet, flocons d’avoine, graines de tournesol, graines de sésame et morceaux de lupins (ces deux derniers sont à signaler sur la liste des allergènes). Un ingrédient « gentil », du miel, mais pourquoi ajoute-t-on aussi du sucre ? Un ingrédient curieux : fibres végétales, est-ce des gommes de guar, des dérivés de cellulose ou autres épaississants d’origine végétale, voir de bois (méthilcellulose), comme on en trouve souvent dans les farines pour pains sans gluten, pour texturer sans les protéines insolubles ? Deux ingrédients « vaguement définis » : huile végétale et graisse végétale. Ce terme on ne peut plus généraliste évite parfois de mentionner les matières grasses les moins coûteuses et exploitées sans trop d’éthique (food-milles, déforestation et exploitation de main-d’œuvre bon marché). Ce « mix » est aussi agrémenté de farine de malt d’orge bien toasté, comme le laisse deviner la couleur du mix.
Si l’on utilise son nom de produit « Pantique » et les produits « marketing » (Plv) qui sont fournis avec, qui mettent bien en évidence « la richesse des céréales d’autrefois », on « doit se tenir à la recette mentionnée sur l’emballage ». C’est-à-dire avec 58 % d’hydratation, 2,5 % de levure au kilo de farine, un pétrissage de 12 à 15 minutes en vitesse lente et 3 minutes en vitesse rapide, un pointage de 30 minutes et un apprêt d’une heure avec un enfournement clé au-dessus pour faire plus rustique dans l’aspect visuel final.
_______________________________________________________________________________
La dernière lisibilité de l’étiquetage est sur ces sacs de farine de blé italiens composé de farine de vieilles variétés-populations cultivées en bio et se revendiquant local en précisant l’origine.
Résumé de plusieurs étiquettes de farine de blé bio et de variétés-population anciennes. On y précise la variété-population ancienne qui a été moulue (Par exemple ; Maiorca, Madonita, engrain, poulard, etc.). Le type de mouture (meules ou cylindres). La région et souvent la ferme ou est cultivé le blé. On signale que la farine contient un allergène (le gluten). Une attestation de conformité avec caractéristique des analyses réalisées peut être jointe.
Cette attestation de conformité de semoule de blé dur, signale parfois que la farine de blé dur est repassée une deuxième fois en mouture plus que probablement sur cylindres lisses et employé pour la fabrication du pain d’Altamura (X.5). Du petit épeautre de Haute Provence attesté Igp (Identification Géographique Protégée) et d’autres où le caractère local et l’identité des producteurs est mis en avant.
Une évolution de circuit court avec un contrôle plus participatif des citoyens, à suivre peut-être. Bien que parfois il faut prendre conscience de l’effet « caviar du blé » au niveau du prix (X.1.) et du fait que la traçabilité se pratique mieux par la connaissance des producteurs que par un papier de conformité qui est quand même un acte déclaré et un écrit.
XVI.6.2. Lecture critique de l’origine du blé et des ingrédients des sacs de farine.
Petit supplément d’informations sur les dessous économiques des ventes de blé et de certains ingrédients de la farine. Avec des sacs d’ingrédients pour farines trouvés à l’intérieur de moulins, on remarque qu’un des fournisseurs d’ingrédients du type, gluten et dextrose est la firme Cargill. Ces sacs ont été vus dans une petite meunerie belge faisant partie d’un grand groupe minotier lors de l’émission « Questions à la Une » du 27-11-2013 consacrée au thème « Artisanal ou industriel, ou est passé le bon pain ? ». On est ici à l’inverse de la situation circuit court et plutôt dans un circuit long[134] et même clairement dans notre exemple, dans un marché « multi-nationalisé ». Avec les grands groupes industriels s’est installé un marché mondial important la matière première et exportant le produit transformé et ainsi quelques grandes sociétés occidentales s’installent et souhaite monopoliser un petit maillon de la chaîne allant du grain au pain[135]. C’est le cas de Cargill, une multinationale de l’ombre comme on l’a dépeint. Ils n’ont pas envie que l’on parle trop d’eux. C’est même pour éviter les publicités nécessaires aux potentiels investisseurs, qu’ils n’ont pas voulu être cotés en Bourse. C’était d’ailleurs une des plus grande société non cotées en Bourse des états-Unis. Cela reste ainsi une société familiale à plus de 88%, les familles Cargill et Mac Millan compte au moins 4 milliardaires. Ils sont actif dans l’agro-alimentaire, mais vous ne verrez pas apparaître leurs noms puisqu’il ne fournisse que des ingrédients de produit alimentaire et notamment ce gluten et ce dextrose.
Le chocolat luisant qui couvre des desserts du type gaufre ou biscuit vient parfois de chez eux, et si vous voyez apparaître de plus en plus du chocolat-caramel c’est peut-être eux qui l’ont conçu et produit. Le Sunny-fresh est une proposition pour les fast-food (leurs principaux clients) à base d’œufs « stabilisés ». La crème glacée à la stévia aussi.
Leur activité commerciale a commencé par le stockage, le transport et la vente de froment.
Il y a plus de 40 ans, dans leur bureau de Minneapolis, il recevait déjà, jusqu’à 14.000 messages par jour [136]. Cela leur permet de connaitre l’état des récoltes du Monde entier et anticiper au mieux l’état du marché à la moisson et les dates de disponibilité de celles-ci. Les grosses transactions, ils peuvent les connaître dès l’affrètement d’un navire (sachant charger jusqu’à 60.000 tonnes) et savoir comment celui-ci pèsera sur les cours de la céréale même pas encore embarqué ce jour-là. Les réglementations européennes, l’évolution des marchés émergents, les solvabilités de clients, les demandes faites au F.M.I. et l’état des consommations tout est tenu en compte. Aucun état n’a ses capacités d’analyses planétaires instantanées, mais bien ces quelques firmes dites, non sans raison, multinationales. Aujourd’hui en 2020, par un système de récoltes d’informations (Cms – système de gestion coopératives numérique) Cargill se veut fournir une banque de données (Cargill Data Platform) gorgée d’informations venant de cartographie polygonale, par Gps ou surveillance par satellite, digitalisation des apports d’intrants à la culture et autres traitements préprogrammés, etc.. Offrant aux clients-usagers, des services de connexion aux producteurs d’intrants et des services bancaires mobiles inclut dans le module. La possibilité d’intervention en cas de crises sanitaires pourrait passer par l’efficacité de ce réseautage, dise-t-il. Les informations de cette banque de données pénètre le Cloud presque en temps réel, et dit servir la traçabilité, la durabilité de demain. Cargill dit aussi pouvoir offrir aux producteurs et aux clients de la firme des services mis en open-source[137]. Mettre en réseau ces producteurs et ses clients est une recherche de plus en plus accentuée des grosses entreprises de l’agro-alimentaire, n’agissant que sur un petit maillon de la chaîne alimentaire, particulièrement rémunérateur. Ce marché du blé, cela se joue aux centimes de bénéfice, mais sur des quantités astronomiques, et avec ce que l’on appelle pudiquement de l’ingénierie fiscale. C’est à dire que Tradax (filiale de Cargill, qui est notre exemple choisi) peut très bien vendre du blé américain à un meunier des Pays-Bas, mais cela passera par Tradax Panama qui réalisera la plus grande marge bénéficiaire (puisque beaucoup moins taxé, là) et le payement s’effectuera chez Tradax-Suisse, pays moins regardant sur les bénéfices effectués sur les taux de change.
Autre appellation que l’on peut traiter de pudique, Cargill a une part d’activité service, dite « gestion du risque ». On peut en effet perdre de grosses sommes dans ces « bourses du blé », mais comment ne pas voir dans cette dénomination, « gestion du risque » la spéculation financière sur cette matière première qu’est le marché du blé, joué en bourse. Surtout dans les marchés dit à terme, ou est fixé avant l’acquit de la récolte, un prix sur une quantité de blé entre acheteur et vendeur. Depuis 1993, en pleine période de dérégulation des marchés agricoles, les spéculations sur les marchés à terme ont été de nouveau autorisées, puisque lors du crash boursier de 1929, ils avaient été interdit. Suite à un loi votée par l’administration Clinton en 2000. Les investisseurs financiers (Banque, Fonds de pension, etc.) vont se jeter sur ce marché ou il y avait moyen de spéculer puisque la Cee et les États-Unis avaient réduit l’écart existant entre l’offre, et la demande, en restreignant les aides au secteur agricole. Dès lors, l’offre et la demande du marché du blé n’a plus rien à voir avec la réalité du marché, mais bien plus avec la rentabilité des « portefeuilles d’actions» des investisseurs-spéculateurs.[138] Il faut savoir qu’il n’y a que 1% des actes de ventes de blé réalisés en bourse qui vont directement du vendeur à l’acheteur. Le reste (99%) est joué en bourse sous forme de titres et serve à cette spéculation financière. Il faut relativiser ces chiffres de 99% puisqu’on sait que les transactions se réalisent à la nanoseconde et dès lors il se réalise beaucoup de transactions. Le blé des farines du marché a été échangé plus de 200 fois sur les divers marchés boursier avant d’arriver au moulin. à la bourse Euronext à Paris, en 2012, environ 29.000 contrats sur le blé ont été traités. A Chicago, sur la plus ancienne bourse du blé au monde (Chicago Board of Trade), il s’échange 46 fois le volume de la production mondiale du blé. Dans les années 2010, en 5 ans, on a enregistré une hausse d’intervention de 2300 % sur le marché du blé de la part des gros fonds d’investissements[139]. Voilà des informations qui vous font prendre connaissance de votre taille au niveau économique et vous rende parfois tout petit, de quoi avoir envie de retourner à des considérations plus techniques et surtout à des économies plus locales, permettant à l’agriculteur de manger du pain de son blé et aux boulangers de connaître l’origine de sa farine.
XVI.7. Le gommage des étiquettes et du gluten trop tenace à désactiver.
Quand on sort de la catégorie des additifs, et que l’on entre dans celle des auxiliaires technologiques. Plus besoin d’indiquer sur l’emballage du pain, E 300, E 322, E 471, E 260, E 280, etc. On gomme les additifs présents sur étiquette.
La Revue de l’Industrie Alimentaire d’octobre 1995 sous-titre un encadré en ces termes : « Des enzymes pour remplacer des additifs ». C’est une technologie « d’aspect plus naturel et qui surtout n’apparaît pas sur l’étiquetage[140] ».
Dans un premier temps (depuis les années 1930), le malt et ses extraits étaient dits à effets « régulateurs » au niveau enzymatique, de ce fait, le terme de correctifs plutôt qu’additifs « colle à la peau » des enzymes.
Dans les deux dernières décennies du xxe siècle, les autorisations d’introduction d’enzymes en panification ont plus que doublées [141] et la Communauté européenne tente, là aussi, d’harmoniser les diverses réglementations de ces membres depuis 1997.
Grâce à cette technologie, si on évite l’additif et ses obligations de publicité d’étiquetage règlementaire sur produits alimentaires emballés, on n’en a pas moins le même résultat technologique.
On remplace le produit provoquant une action enzymatique par l’enzyme.
Ainsi la lipase, enzyme dégradant les lipides (graisses), remplace efficacement les émulsifiants, la glucose-oxydase succède aux acides ascorbique et bromate (fig.5), les amylases se sont substitués au malt présent depuis 50 ans déjà, les protéases alternaient leur présence avec la L-Cystéine avant de voir un autre ingrédient rival sur ce secteur, la levure désactivée.
Les levures désactivées sont devenus un produit commercialisé depuis le début des années 1990 afin de rectifier la trop grande ténacité du gluten des farines qui rétracte dès l’allongement (fig.10) et l’abaisse des pâtons destinés à la confection de baguettes, petola de pizza ou de la croissanterie. Eh oui ! Il faut parfois s’y prendre à deux, trois fois pour étendre la pâte, avec un temps de repos entre deux.
On a tellement exagérer dans la ténacité du gluten obtenu de nos jours que l’on en est au point d’avoir ces effets techniques négatifs où le volume ne parvient plus à se « décontracter ».
Ainsi, c’est un peu de détente, d’extensibilité, face à l’excès de ténacité rétractable, que l’on apporte avec les levures désactivées. Cet apport de glutathion (XVI.10.3) à effet réducteur (fig.11) est nettement plus développé vingt ans après sa venue sur le marché. Cette action permet de comprendre qu’une pâte levurée laissée longtemps en suspens et à température ambiante peut procurer ces effets de relâchement. Le plus souvent, un apport partiel de pâte levurée « abandonnée » longtemps dépassera cet effet de relâchement et donnera du collant assez rapidement à toute la pâte à laquelle on l’intègre (XVI.10.3).
On en reparlera (XVII.1.5) puisque la maîtrise du procédé d’ajout de pâte pré-fermentée « relaxante » est possible, néanmoins, elle exige plus d’observation et mise au point des doses et méthodes que l’ajout du produit commercial proposé, la levure désactivée, de nouveau plus commode à l’emploi [142].
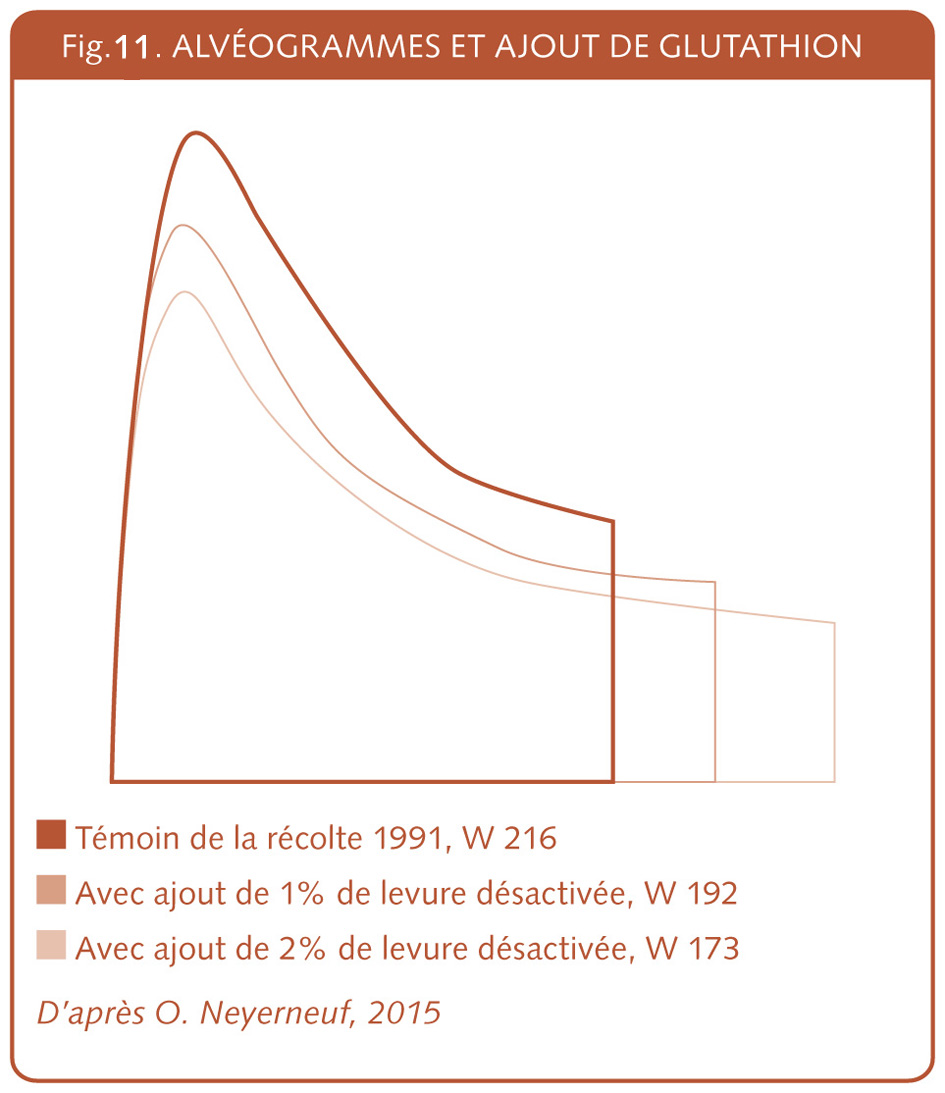
Un peu nouveau dans notre vocabulaire professionnel, les enzymes pentosanases (le plus souvent notées hémicellulases sur les étiquettes) s’impliqueront d’abord déguisées en « agent secret » (XVI.12), puis presque (comme une innovation) elles réalisent comme un gel à cru et prenant en compte le développement au four dans le court temps instant, où les enzymes sont encore super efficaces dans la chambre de cuisson, (XVI.11.2).
Faisant du hors piste vis à vis du statut d’auxiliaire technologique, les amylases bactériennes resteront actives après cuisson pour essayer de prolonger le moelleux ou garder la fraîcheur (XVI.11.1).
Dans ce domaine plus complexe d’ajout d’enzymes dans un milieu pâteux, vu la difficulté d’interpréter l’incidence technique, si une information n’est pas publiée, ni enseignée, on aboutit inévitablement à des données occultes, qui ne permettent pas de faire une distinction compétente entre les effets correctifs et additifs de l’ajout enzymatique à une pâte de farine, eau, ferments et sel. Les boulanger(e)s vivent cette difficulté d’évaluation des actions et des doses lorsqu’ils souhaitent les employer ou simplement exprimer leur position, ou lorsqu’ils veulent éviter leur emploi et la standardisation du marché qui en découle.
Quels sont les enzymes présentes naturellement dans la farine, en cas d’ajout à quelle dose opèrent les meuniers et quels types d’ajouts sont-ils opérés ?
Les enzymes proposées aux boulangers sont-elles natives du blé ?
On va tenter d’y répondre en comparant le positionnement des enzymes natives (XVI.10) et les propositions d’amendement d’enzymes exogènes (XVI.11) qui suivent.
XVI.8. L’histoire de l’enzymologie des farines
L’invisible à l’œil nu parce qu’infiniment petit est un monde où l’on va tenter de voyager.
C’est aussi un univers où les définitions seront toujours plus précises. Pour bien faire, il serait souhaitable que ce langage ne soit pas exclusivement employé et compris par des scientifiques créateurs et formulateurs d’enzymes, mais surtout par les utilisateurs finaux de la filière et les consommateurs.
Passons, si vous le voulez bien, par les premiers « légos », puis chaque fois, installons les suivants, qui construisent petit à petit la maison qu’est actuellement l’enzymologie céréalière, science ou intervention dernier cri dans la boulangerie.
Commençons dès 1833, avec les Français Anselme Payen et Jean-François Persoz qui avaient déjà découvert l’enzyme qui dégradait l’amidon. Ils l’appelèrent « diastase » du grec « séparer » [143].
Après, vint « l’époque Louis Pasteur » qui apporta les bases à ce qui allait devenir la microbiologie.
Mais, si l’on était, au milieu du xixe siècle, à peu près certains que les « germes » étaient de microscopiques êtres vivants, les enzymes sont dans un premier temps réunis avec les microbes sous la dénomination, « ferments ».
Progressivement dans ce siècle, on séparera les ferments « organisés » ou « figurés », des ferments « inorganisés » ou « solubles ». Émile Bourquelot dira en 1889 de ces derniers (les solubles ou enzymes de nos jours), qu’ils « dérivent tous directement de microorganismes vivants[144] ». Les chercheurs en ce domaine furent très peu désarçonnés en l’été 1896, lorsque l’allemand Eduard Büchner et son frère Hans, qui avait complètement broyé les levures, virent après l’ajout de sucre, apparaître quand même la formation de bulles.
C’est la fermentation sans levure !
Les frères Büchner reprendront l’expression zymase crée par Antoine Béchamp (*1816-†1906) qui avait fait la même découverte relatée dans « Mycrozymas » en 1883, soit treize années avant la publication des frères Büchner.
En discutant sur l’interversion du sucre de canne, dans un compte-rendu intitulé « Sur la fermentation glucosique du sucre de canne », Marcelin Berthelot précisait déjà en 1860 : « On voit clairement ici que l’être vivant n’est pas le ferment, mais c’est lui qui l’engendre ».
Peut-on dire que « le fantôme de la machinerie biologique se trouvait ainsi exorcisée » avec la communication du bavarois Eduard Büchner, qui en recevra le prix Nobel de chimie en 1907 ? Elle est démontrée et publiée en tout cas, car avant cela d’autres recherches avaient plus qu’ouvert la voie.
C’est un autre Allemand, Wilhelm Kühne, « découvreur » de la trypsine (enzyme digestive) qui est à l’origine du mot enzyme qui provient du grec « en » « zumé » qui signifie « dans » « levain ».
Six années plus tard, toujours en Allemagne, encore un prix Nobel de Chimie. Emil Fischer (*1852-†1919), éminent chercheur, avait en 1883, grâce aux biens que possédait sa famille, choisi de continuer une carrière académique plutôt que de diriger le laboratoire de recherche de la Bade Anilin und Soda Fabrik (Basf). En 1894[145], il a élaboré la thèse de la complémentarité moléculaire entre les enzymes et les substrats sur lesquels l’enzyme agit, en comparant l’enzyme à une serrure et le substrat à une clef. Il était en recherche sur les structures des protéines, avant de se lancer dans l’étude des sucres. C’est par ce chemin d’approche différent de l’étude de la fermentation qu’il arrive à proposer la compréhension de cette association spécifique entre le substrat et le ferment. Malheureusement, après avoir perdu deux de ses fils à la guerre 14-18, Emil Fischer se donne la mort.
Plutôt spécialiste de l’étude de la fermentation panaire, Léon Boutroux devrait nous amener un peu plus sur notre métier en passant en revue les derniers apports de la science pour la panification, fin du xixe siècle. Toutefois, il ne peut qu’écrire « …à la suite de l’immense développement qu’ont pris les recherches bactériologiques, l’étude des diastases et celles des transformations des hydrates de carbone, une théorie simple ne pouvait plus conserver d’autorité ; mille faits nouveaux venaient chaque jour compliquer la question et suggérer des hypothèses nouvelles[146]. »
Rien de tel alors que l’application sur le terrain pour remettre la prise de terre et dénouer les balbutiements de ces spécifications scientifiques naissantes.
C’est dans un métier qui s’industrialisera assez vite (la brasserie) que l’usage du malt d’orge sera le plus étudié et permettra d’en copier par après l’emploi « déjà maîtrisé » pour la boulangerie[147]. À ces débuts les « préparations maltées » sont ajoutées à la farine en quantité minime (0,5 à 0,7 %) afin de permettre un meilleur « pouvoir liquéfiant », (on parle de « dégradation enzymatique » de nos jours) et ainsi activer favorablement la fermentation des levures au sein de la pâte. Il s’agit à ce moment d’aide circonstancielle lorsque les récoltes des années sèches procuraient une farine lente au démarrage de la fermentation (VII.5). Ce qui se vivra plus au Sud de l’Europe qu’au Nord. L’apparition en boulangerie de l’extrait liquide de malt en tant que produit commercial, considéré plus stable, est facile à dater.
La firme du pharmacien Wander de Berne débuta en 1865 et fera après les premiers aliments fortifiants à base de malt, un produit commercial plus que renommé, l’Ovomaltine. Celui-ci est composé aussi d’extrait de malt, auquel on ajoutera en 1904 de la poudre d’œuf, de lait et plus tard du cacao. La firme Wander entrera dans le giron du groupe Sandoz en 1967, puis sortira en 2002 de Novartis (fusion Sandoz/Ciba-Geigy en 1996) pour intégrer l’Associated British Food – ABF. Ce premier produit malté mentionné, le « Diamalt », avait comme représentant d’une firme collaborant par la suite avec Wander de Berne, un personnage qui est aussi un écrivain d’une histoire française de la boulangerie. Il s’agit d’Ambroise Morel qui donne l’année 1906 pour les débuts de l’extrait de malt en France[148]. Et technique de vente innovante pour l’époque, il est également précisé que la firme Diamalt « emploie dès 1912 le service de démonstrateurs[149] ».
Le commercial (Ambroise Morel) vante son article en ces termes ; « ce produit active la pousse, procure au pain un grand développement, lui donne un goût exquis et permet de conserver longtemps sa fraîcheur ».
Après ces premiers descriptifs, le malt en extrait ou en sirop[150] va aussi plaire en tant qu’apport de goût.
La farine de malt résulte de la germination d’une graine de céréale, généralement l’orge, (fig 5 du chapitre XI.7), mais cela peut être le froment. Ces graines germées sont ensuite séchées une trentaine d’heures à des températures de 60 °C à 70 °C, séchage terminé par une phase « coup de feu » à 80 °C / 100 °C. Cette fin de séchage (appelé touraillage), donnera, suivant sa conduite, différentes couleurs aux malts puis aux bières qui en résultent : blonde, brune, noire.
Puis suit le dégermage extrayant les radicelles des germes (XI.7). Cette matière première subit soit un concassage pour la brasserie, soit un broyage plus fin pour la meunerie.
Ce que l’on appelle les extraits de malt dérivent de la farine de malt. Le sirop de malt est le résultat d’un re-trempage du malt avec une nouvelle hydrolyse enzymatique suivi d’une évaporation sous vide.
L’extrait de malt cristallisé pousse plus l’évaporation de l’eau. À la place de l’obtention d’un sirop, on arrive à des cristaux de conservation difficile. Les extraits de malt contiennent ainsi en concentré plus de maltose que la farine de malt.
Pour l’emploi du goût « malté », il faut signaler que beaucoup de malts de boulangerie utilisés aujourd’hui ne sont plus diastasiques (XVI.6.1), écrit autrement ils ne sont plus actifs enzymatiquement.
Tous les malts rouges de seigle utilisés en Russie (pour le pain Borodinski) par exemple et souvent en Allemagne (pour le Pumpernickel) sont inactivés thermiquement (XI.1).
 En réalité, peu de malts utilisés en boulangerie apportent une activité amylasique, il suffit d’aller sur le catalogue des firmes vendant du malt comme me l’a fait remarquer Thomas. L’offre du malt, surtout au nord de l’Europe, est pratiquement un apport de couleur, dans la gamme de malts proposés, où des dénominations de couleurs caramel et chocolat, seront employées dans la définition commerciale du produit[151].
En réalité, peu de malts utilisés en boulangerie apportent une activité amylasique, il suffit d’aller sur le catalogue des firmes vendant du malt comme me l’a fait remarquer Thomas. L’offre du malt, surtout au nord de l’Europe, est pratiquement un apport de couleur, dans la gamme de malts proposés, où des dénominations de couleurs caramel et chocolat, seront employées dans la définition commerciale du produit[151].
Précisons qu’en apportant des sucres déjà dégradés dans la pâte, le malt désactivé favorise, un peu comme le sucre, l’action des amylases natives de la farine et celles des microorganismes de la fermentation.
Un des premiers pains de marque sera le « Pura-malté » de la firme Puratos[152]. Ses débuts datent de 1923. Un ancêtre du mix boulanger (XVI.4.11) en somme, farine ou mélange d’adjuvants et de farine prêtes à l’emploi.
La plus forte coloration de la croute pourra aussi être l’objet d’exploitation, mais finalement on évitera plutôt le « rougissement » de la croute parce que le goût caramélisé est trop souvent reçu comme « trop cuit » par la clientèle.
Cette interprétation (amélioration du goût) par l’apport de malt en boulangerie nous éloigne d’un but initial de régulation, qui devrait « gommer les fluctuations du bagage enzymatique » suivant l’état de la récolte. On passe ici clairement à un profil d’amélioration gustatif de la pâte. Ces deux exemples d’emploi du malt très distincts (activant la pousse, apportant goût et coloration) permettent de faire apparaître la différence entre « corriger » une teneur enzymatique naturelle et ajouter le produit pour en améliorer la farine et le pain qui en résulte.
Le souhait de se « soumettre à la question » : est-ce du correctif ou de l’additif ? sera la ligne de force du thème « ajout enzymatique », afin d’aiguiser notre discernement professionnel, puisque bien peu affuté actuellement. Nous le ferons mieux en identifiant la méthode de panification naturelle (XVI.10) afin de mieux pouvoir évaluer le positionnement témoin. On tentera plus loin de voir si l’apport est correctif ou additif (XVI.13).
Depuis un bon moment, on panifie de manière généralisée des farines blutées, de ce fait, il faut lire d’anciens textes pour avoir les témoignages qui suivent.
Le premier vient d’un manuel de boulangerie : « l’emploi du sucre de malt est indiqué pour améliorer les farines pauvres en enzymes – farine blanche[153] ». Nous sommes à la moitié du siècle passé avec ce commentaire de professionnels.
Un an après cet écrit de 1949, un spécialiste en enzymologie naissante, écrit : « si l’on part de farines blanches qui sont extraites à des taux très bas et qui ont peu d’enzymes, il est nécessaire d’utiliser des produits améliorants[154] ». Il apparaît bien que la farine subissant par le tamisage le retrait des parties périphériques du grain se carence en enzymes et en co-enzymes, une fois qu’elle n’est plus que la mouture de l’amande du grain.
Alors reprenons la question que nous désirions soumettre ; dans le cas de figure d’une farine blanche comparée à une farine complète, l’ajout d’enzyme est-il assimilable à un correctif ou un additif ?
Pas facile d’y répondre, puisqu’on pourrait dire qu’il s’agit plus d’une évolution du à un choix « comptoir » du consommateur.
Ce supplément enzymatique semble bien dû à une carence, que l’on pourrait considérer commercialement comme inévitable d’après ces deux sources venant d’horizons différents.
Il se peut aussi qu’il existe une carence de co-enzymes (XII.12 et XVI.9.1.1) par le blutage d’autant que ces derniers (contrairement à l’enzyme) ne se renouvellent pas.
Dans l’évolution que l’on vient d’analyser, on voit que l’ajout de produits maltés engendre une accélération à la fermentation et une augmentation de volume. Cela fait qu’il deviendra difficile encore une fois de distinguer l’effet correctif de l’effet additif.
Fallait-il obligatoirement aller plus vite et vouloir le maximum de volume ?
Un comptable performant ou un technicien soucieux des aspects gustatifs et nutritionnels risquent bien de donner des réponses différentes, même s’ils font partie de la même entreprise.
De nos jours, l’on peut imaginer aisément, avec le recul historique, lequel des deux avis a été pris en compte. Il est en tout cas évident qu’il est difficile de croire qu’avec l’apport de malt, l’on ne fait pas que réguler la faiblesse diastasique des céréales due certaines années à un climat trop sec, que celles-ci subissaient.
Analysons l’hyper… et l’hypo…diastasique, soit dans l’ordre le « trop » et le « trop peu » d’activité amylasique.
Sous nos climats tempérés et suivant la pluviométrie, la récolte pourra être hyperdiastasique. C’est-à-dire venant de lots de grains de blés ayant entamé le processus de germination sur pied et contenant trop d’enzymes qui dégraderont trop vite la pâte de farine issue de ce type de blé germé sur pied. Lorsqu’un petit bout de germe a percé les enveloppes la dégradation devient irrémédiable et exponentielle.
Cas de figure inverse, dans des années ou la sécheresse domine, ce sera l’hypodiastasique (ne dégradant pas assez vite la pâte) qui se manifeste. L’apport de malt diastasique ne devrait venir que en ce dernier cas, pour réguler ce type de comportement de la farine.
Sûrement pas dans le cas hyperdiastasique où l’ajout de malt amplifierait encore plus la dégradation de la pâte, puisqu’en plus les protéases (inclues dans le malt actif) dégradent inévitablement en parallèle les chaînes de gluten.
Si l’on parle d’effet régulateur du malt pour ces conditions climatiques changeantes, il faut quand même signaler que c’est surtout l’hyperdiastasique qui est l’incident climatique le plus fréquent au Nord de l’Europe, et qu’au Sud de l’Europe ce sera l’inverse. Dans les années 1950/1960, c’est le blé germé sur pied causant problème qui oblige l’encadrement scientifique de la boulangerie française à approfondir le thème[155].
Le secteur de la boulangerie dans les pays anglo-saxons a trouvé une toute autre réponse que le malt à l’hypodiastasique, depuis les années 1960. C’est à l’étape mouture, en endommageant l’amidon, que la solution est apportée (XII.7). Elle permet l’accélération de la fermentation par activation enzymatique.
C’est encore l’époque où le Chorleywood Bread Process est influent (XVI.4.8) que cette accélération du travail s’amplifie dans la pratique[156].
Les années qui vont suivre, la Politique Agricole Commune (dite Pac) va influencer fortement le marché. Sous le double effet des prix plancher d’intervention accordé par la Cee et l’élévation des rendements, la qualité panifiable du blé, moins rentable à l’hectare et mal rémunéré en conséquence, va perdre de l’intérêt aux yeux des céréaliculteurs (III.3). Le blé fourrager va, lui, accompagner l’augmentation de la consommation de viande, grande consommatrice de céréales. Déclassés de la qualité boulangère, les blés hyperdiastasiques iront vers ce marché de la consommation carnée en progression.
Tout ceci pour signaler que quand, vers 1993, la Communauté Européenne va vouloir baisser ces mécanismes de production de blé devenus excédentaires et générateur d’une gestion de stock coûteuse budgétairement, l’institution liera la subvention des récoltes de blé à la qualité et notamment à l’indice mesurant l’activité enzymatique de la farine de blé.
Cet indice se mesure grâce à un appareil qui s’exprimera en temps de chute d’Hagberg[157] (du nom de Sven Hagberg, un chercheur suédois) qui permet depuis 1962 de mesurer le temps de chute de l’agitateur dans la solution pâteuse tenue dans un tube (fig.9 dans IX.5).
Après ces trois remarques sur les effets du malt (goût, rapidité de fermentation et le caractère peu influant des récoltes hypodiastasiques), que l’on pourrait presque qualifiée d’approche préliminaire, voyons la suite.
Comme la science évolue[158] et que l’on sait produire séparément des enzymes, on se passe du malt en tant qu’ajout. Au milieu des années 1990, Jérome Souppe, de la firme Lyven productrice d’enzymes, écrit : « On peut ici souligner la faible productivité du végétal par rapport au microbien : ainsi pour effectuer un brassin mixte engageant 70 kg de malt […], un brasseur pourra liquéfier : soit par 20 % de son malt, c’est-à-dire 14 kg de malt, ce qui correspond à environ 17 kg d’orge initial et quelques jours de maltage. Soit par l’amylase commerciale de Bacillus licheniformis où 12 grammes de moût, fermenté quelques jours, sont nécessaires » [159].
Sur le site de Mühlenchemie[160], où on se dit les créateurs de la première amylase fongique commerciale (l’Alphamalt), on cite comme date d’apparition de celle-ci sur le marché, 1952.
Au Japon, pays de tradition des aliments fermentés, Jokichi Takamine produit des enzymes depuis longtemps. Dès 1891 il dépose des brevets aux états-Unis (qui deviendra son pays d’adoption), pour fabriquer celles-là à l’aide de la moisissure, aspergillus du riz.
Bien avant le début des années 1970, on n’extrait plus l’enzyme amylase du broyat de levure sur milieu riche en sucres ou de grains ayant subi un « maltage » (XVI.8), mais on cherche à les produire par ces merveilleuses petites machines biologiques que sont les microorganismes de toutes sortes, agissant dans un espace-fermenteur.
C’est le chercheur J. Souppe, (cité plus haut) qui écrit en 1997 que « … pour comparer la productivité d’une plante à celle d’un microorganisme. Un hectare de papayer produit environ 300 kg de protéine enzymatique par an », alors qu’un « fermenteur industriel de 100 m³ utilisé pendant un an » peut « fabriquer une enzyme d’origine microbienne » ; à raison « de 10 g/litre, le fermenteur industriel aura sur cinq jours de fermentation, fourni environ 30 tonnes de cette protéine enzymatique. Soit l’équivalent d’une plantation de 100 hectares environ, d’un végétal pourtant particulièrement productif comme le papayer[161] ».
De plus les amylases produites par ces champignons microscopiques auront une propriété intéressante. Elles n’ont pas les mêmes caractéristiques que les amylases natives du blé tendre. Ces amylases dites fongiques se désactivent à la cuisson à 75 °C/80 °C, tandis que l’a-amylase fongique se désactive à 65 °C/70 °C. Soit plus tôt que les amylases du malt et les autres amylases natives de la farine. Dès lors l’évitement d’un surdosage trop « liquéfiant » est plus aisé. Un choix qui plait par sa facilité d’emploi aux formulateurs de cocktail enzymatique, métier que nous découvrons dans ce sous-chapitre.
En France, la première amylase fongique est autorisée en 1983, même si probablement elles sont présentes avant ces dates, puisqu’en fin août 1979, une autorisation provisoire est déjà délivrée.
Pour s’attarder sur ce terme d’autorisation provisoire, signalons que l’enzyme glucose-oxydase (en abrégé Gox) la recevra aussi en mars 1995 avant d’être agrée officiellement deux ans plus tard, en 1997. Si l’on doit approfondir le parcours de la reconnaissance législative de l’ajout enzymatique dans les transformations de produits alimentaires, nous devons pas seulement parler des autorisations provisoires, mais on doit aussi passer par les cases « activités secondaires » et « auxiliaires technologiques ».
Des « effets ou activités secondaires » de l’enzyme amylase sont dans un premier temps découverts et puis un peu après clairement déclarés. De quoi s’agit-il ? Aux premiers temps d’exploitation commerciale des produits enzymatiques, la purification de ceux-ci n’était pas ce qu’elle est devenue de nos jours. De plus, les « effets secondaires » peuvent dépendre du « patrimoine » de l’organisme producteur, mais aussi des conditions de culture[162]. Ce constat d’activités secondaires sera encore plus lisible lors de l’ajout d’enzymes sous forme de malt, non désactivé, où parfois des protéases coexistent avec les amylases[163].
Le malt est moins « purifié » que les préparations enzymatiques issues de microorganismes. Quoi de plus normal, dès lors, de remplacer le malt au spectre d’action trop large par l’amylase, en essayant d’éviter la dégradation des protéines du gluten.
On peut donc avoir dans les enzymes produits des « impuretés » ou des effets qui seront dits secondaires.
Observons, comme le montre Ph. Roussel en 1988[164], que dans les amylases fongiques testées, ce sont justement ces amylases à activités secondaires qui donnent souvent les meilleurs résultats au niveau du volume. Les pentosanases qui réalisaient probablement ces effets secondaires ne seront autorisées qu’en 1993, soit cinq ans après ce constat recensé lors de cette étude.
De nos jours, la pureté de l’enzyme est considérée comme une qualité et c’est aussi celle qui est la plus « purifiée » qui réalise le plus rapidement son action devenue, il faut bien le dire, plus spécifique.
Survient en France le décret pain, le 13 septembre 1993. Pour le pain de tradition française, l’additif est interdit et notamment l’acide ascorbique. En meunerie, l’acide ascorbique à de très faible dose s’était imposé très vite comme l’adjuvant le plus avantageux au niveau du rapport qualité-prix et services rendus (XVI.4.8).
Après plus de quarante années d’usage de l’acide ascorbique en panification, comment les deux secteurs (meunerie et boulangerie) pourront-ils se priver de ces avantages pour bénéficier de l’appellation « pain de tradition française ».
Pour les firmes para-boulangères, les premières à réagir, la réponse vient des enzymes. Pourquoi, les enzymes ? De nouveau, parce qu’ils n’ont pas le statut d’additifs mais d’auxiliaires technologiques et que ce sont les additifs que le décret pain de tradition interdit.
Les auteurs d’un article technique recherchent une alternative « capable de reproduire l’action de l’acide ascorbique ». Ils écrivent notamment dans la conclusion de leur article, que « si la Confédération de la Boulangerie décidait d’exploiter les nouvelles opportunités qu’apporte cette enzyme [la glucose-oxydase], alors pourraient être créées les conditions pour que le pain de tradition puisse enfin faire la percée espérée […] en 1993[165] » .
Notez que les enzymes « oxydantes » (par exemple ; GlucoseOXydase ou Gox et HexoseOXydase ou Hox), ne seront jamais autorisées en panification dite de tradition française, suivant le décret de 1993. Pour que ce propos ait une réel teneur, encore faut-il pouvoir le contrôler, ce qui est tout, sauf évident. Car les gluco-oxydases ne sont pas facilement décelables et l’on peut franchement se poser la question, si les organismes de contrôle ont entrepris des contrôles à ce sujet ?
Si ce mélange d’enzymes avec la glucose oxydase et l’hémicellulase pouvait ainsi être ajouté à la farine de tradition française, on pouvait légitiment se poser la question si l’on n’essayait pas de contourner l’esprit de la loi en essayant d’intégrer dans la farine non plus un ingrédient engendrant des réactions enzymatiques, mais les enzymes eux-mêmes, fussent-ils non natifs dans le blé et son produit de mouture.
Ces péripéties démontrent encore l’avantage du statut d’auxiliaire technologique vis-à-vis de l’additif auprès de l’industrie. Un statut où comme souvent la définition sera sujette à interprétations divergentes.
Un auxiliaire technologique devrait être une substance non consommée parce que généralement dégradée au cours du processus de transformation[166].
| fig.13. Petit résumé de l’historique de l’enzymologie
et spécialement de son implication « boulangère » |
|||
| Dates | Interventions de la recherche | Titres des livres | |
| 1833 | Anselme Payen (Fra) et
Jean-François Persoz (Fra) |
Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels | |
| 1883 | Antoine Béchamp (Fra) | Mycrozymas | |
| 1891 à 1894 | Jokichi Takamine (Jap) dépose une série de brevets d’abord au Japon puis aux États-Unis d’Amérique.
Ces inventions vont permettent la production industrielle d’enzymes par les moisissures (Aspergillus). |
||
| 1892 | Jacob Hauser et Moritz Sobotka (Aut) lancent le premier Diamalt. | ||
| 1894 | Hermann Emil Fischer (Deu) | Influence de la configuration sur le travail des enzymes | |
| 1896 | Eduard et Hans Büchner (Deu) | Fermentation alcoolique sans cellules de levures | |
| 1896 | Auguste Boidin & Auguste Collette (Fra) | Procédé d’utilisation des moisissures | |
| 1899 | Jean Effront (Prof. à l’Univ. de Bruxelles) | Les enzymes et leurs applications | |
| 1906 | Première commercialisation de l’extrait de malt venant de Suisse en boulangerie française | ||
| 1907 | Otto Röhm (Deu) découvre une protéase pour le tannage et lance son entreprise pour la production industrielle d’enzymes. | ||
| 1922 | Auguste Boidin (Fra) et Jean Effront (belge d’origine lituanienne) créent la société Rapidase en France. | ||
| 1923 | L’entreprise Puratos (Bel) lance la première farine prête à l’emploi, maltée, pour le pain « Puramalté ». | ||
| 1952 | Première enzyme obtenue par le procédé microbien chez Novo (Dkn) pour l’industrie textile. | ||
| 1952 | Production de la première amylase fongique commerciale de l’entreprise Mühlenchemie (Deu) ; l’Alphamalt. | ||
| 1958 | Sven Hagberg (Swe) | Méthode diastasique pour la farine de froment et de seigle | |
| 1962 | Sven Hagberg vend la patente de son appareil permettant de mesurer l’activité enzymatique de la farine à Harald Perten (Swe). | ||
| 1973 | Première hémicellulase (xylanase) commercialisée par Röhm (Deu). | ||
| 1979 | Première autorisation pour l’amylase fongique en France. | ||
| 1991 | Première amylase bactérienne thermorésistante par Novozymes ((Dkn). | ||
| 1992 | Première lipase pour la panification (Lipopan) produite par Nozozymes (Dkn). | ||
| 1994 | Première autorisation d’enzymes issus de microorganismes génétiquement modifiés en France. | ||
| 2008 | Règlement d’harmonisation des législations européennes sur les enzymes. | ||
| D’après Dewalque, 2012. Les livres ou articles cités. Wikipédia pour certaines personnes et les divers règlements | |||
XVI.9. Les paramètres influant sur les enzymes
XVI.9.1. Cours préliminaires sur les enzymes
L’enzyme ?
On va essayer que ce sous-chapitre existe, pour que le point d’interrogation derrière le mot enzyme ne reste pas indéfiniment une énigme pour le boulanger.
Pour ce faire commençons par une histoire un peu « crue ». Un reporter/explorateur, connaissance de jeunesse, est spécialiste de l’Amazonie. Lors d’accueils qu’il reçut dans des tribus ne voyant pratiquement pas de « gringos », il vit à l’entrée du village une vieille indienne qui mâchait un aliment et qui crachait le résultat de sa mastication dans un bol. Bol que, juste après, il dut boire en symbolique d’accueil. En fait, la « boisson amazonienne » est une espèce de pré-digestion de l’aliment mâché.
Notre appareil digestif est l’endroit où dans la race dite humaine, les enzymes sont le plus présents. Ici dans notre exemple précité, la digestion commençait à peine avec les enzymes existants dans la salive. Elle se poursuivra dans le parcours de l’aliment tout le long de l’appareil digestif (fig.6 dans VII.5).
D’autres vécus où apparaît le travail des enzymes, ce sont par exemple les diverses transformations de la viande. Servie dès l’abattage elle est coriace, il faut attendre une certaine maturité (au moins 1 jour) pour qu’elle soit plus tendre. Cet attendrissement se réalise grâce aux enzymes protéases, celles qui dégradent les protéines. Plus loin en durée et en lieu, dans l’Asie du Sud-Est, le poisson peut se dégrader tellement grâce aux enzymes que l’on obtient avec une très longue durée, la forme liquide de sauce[167].
XVI.9.1.1. Schématisation de l’enzyme et de son action.
Passons au cours d’enzymologie céréalière.
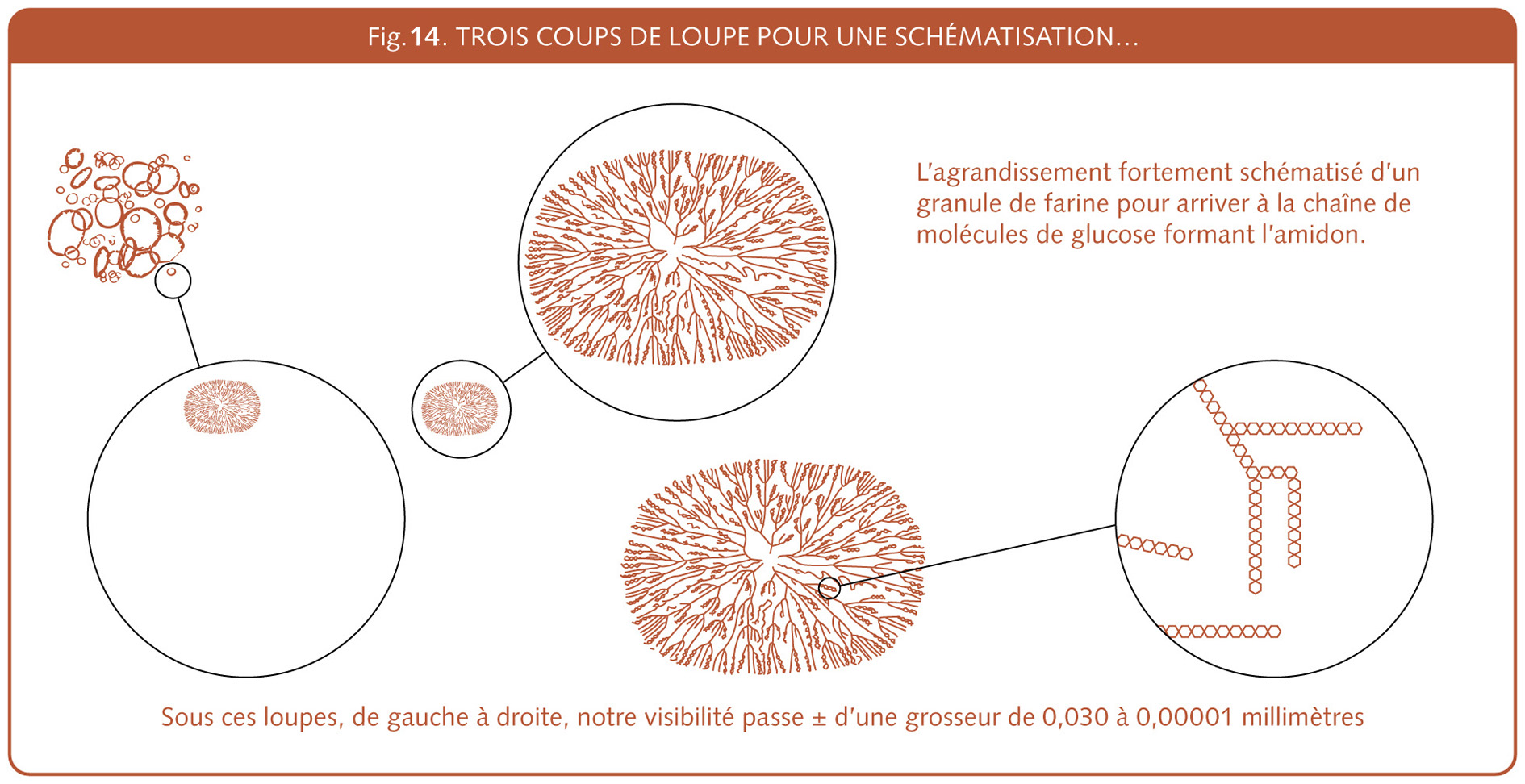
Voici représenté (fig.14) des granules d’amidon de farine de blé. Pour la compréhension c’est schématisé assez fort. Agrandissons à la loupe pour nous aider à comprendre. On obtient une granule qui est composée (toujours aussi schématiquement) des chaînes d’amidon
Ces chaînes d’amidon sont composées de molécules de glucoses accolées une à l’autre.
Chaque petite molécule hexagonale représente une de ces molécules de glucose. Celles-ci sont reliées entre elles.
En reprenant ce schéma, représentant l’amidon, qui est présent dans la farine, on aperçoit distinctement l’amylopectine avec ses ramifications ou branchements, qui est majoritaire (± 70%) dans l’amidon. Les ± 30% restant c’est l’amylose de l’amidon, il est lié en ligne mais sans ramifications.
Maintenant, dans la farine, il n’y a pas que les glucides (nom général des sucres, dits aussi hydrates de carbone). Il y a aussi les protides (ou protéines) et les lipides (ou graisses) dans les trois apports primordiaux au niveau nutrition humaine. Eux aussi (les protides et les lipides) devront se dégrader ou se fractionner par dégradation enzymatique en de petites unités afin de passer du statut d’aliment à nutriment (fig.6 dans VII)
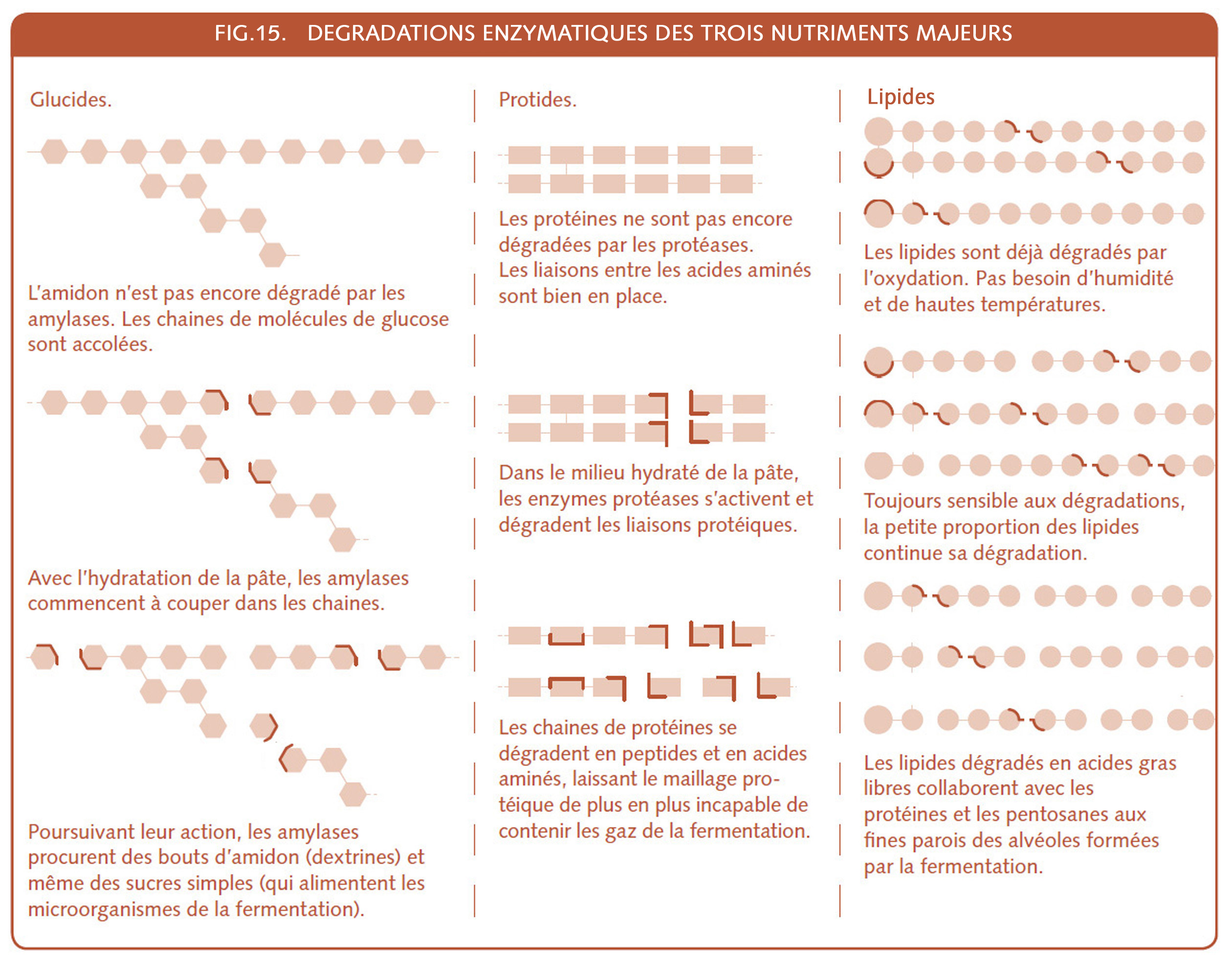
Le monde vivant (genre animal et végétal) doit, pour se nourrir et croître, dégrader enzymatiquement ou couper dans leur plus petite taille moléculaire les aliments pour que ceux-ci deviennent des nutriments et chez l’humain passer la barrière intestinale.
Un des exemples les plus simples parce que souvent cités est l’amidon. Il est composé de centaines à des milliers de molécules de glucose accolées une à l’autre.
Pour l’humain, il ne va pas être possible de faire passer la barrière intestinale à une si grande chaîne de molécules de glucose qui compose le granule d’amidon (fig.6 dans VII.5).
Il faut que dans notre appareil digestif, cette chaîne de molécules de glucose accolées l’une à l’autre soit petit à petit dégradée et qu’ainsi, ce soit molécule de glucose par molécule de glucose qu’ils « entrent » dans le sang et nous fournisse l’énergie nécessaire à nos activités.
Il faut savoir qu’un humain, même au repos, consomme environ 10 grammes de glucose à l’heure[168]. Voilà aussi pourquoi l’on parle de taux de glucose sanguin et non de taux d’amidon sanguin. On parlera aussi de sucre lent et sucre rapide. Le sucre lent est généralement représenté par le pain et les pâtes contenant très peu de sucres rapides (1 à 2 %) et beaucoup d’amidon. Comme ces chaînes d’amidon (réserve de centaines voire de milliers de molécules de glucose liées une à l’autre) dégraderont ces liens progressivement, elles vont fournir de l’énergie (ou du sucre) tout le temps de cette dégradation en molécules simples (du glucose), pendant plusieurs heures.
Le sucre rapide (le morceau de sucre composé de saccharose ou le sucre des sodas) ne sont composés que de deux molécules de glucose (le maltose), ou d’autres sucres simples. Il est évident que ces deux molécules se dégraderont plus rapidement et de ce fait seront plus vite assimilées en termes d’énergie transmise à notre corps, d’où l’appellation ; sucre rapide.
On a vu (VII.5) que ces théories de sucres lents et rapides seront revues régulièrement ces dernières années au niveau de la diététique et la lutte contre le très prégnant diabète.
On va continuer toujours avec des schémas, pour proposer des images à la compréhension des enzymes. Quand on voit nos chaînes d’amidon avec un dessin inspiré de Rawn[169], les enzymes sont représentées en espèces de gros globules bien plus grand que le substrat dégradé et l’on remarque également dans la figure 15, une double membrane qui figure les parois cellulaires de la levure et son espace périplasmique bien utile pour la dégradation enzymatique de certaines molécules dont le maltose.
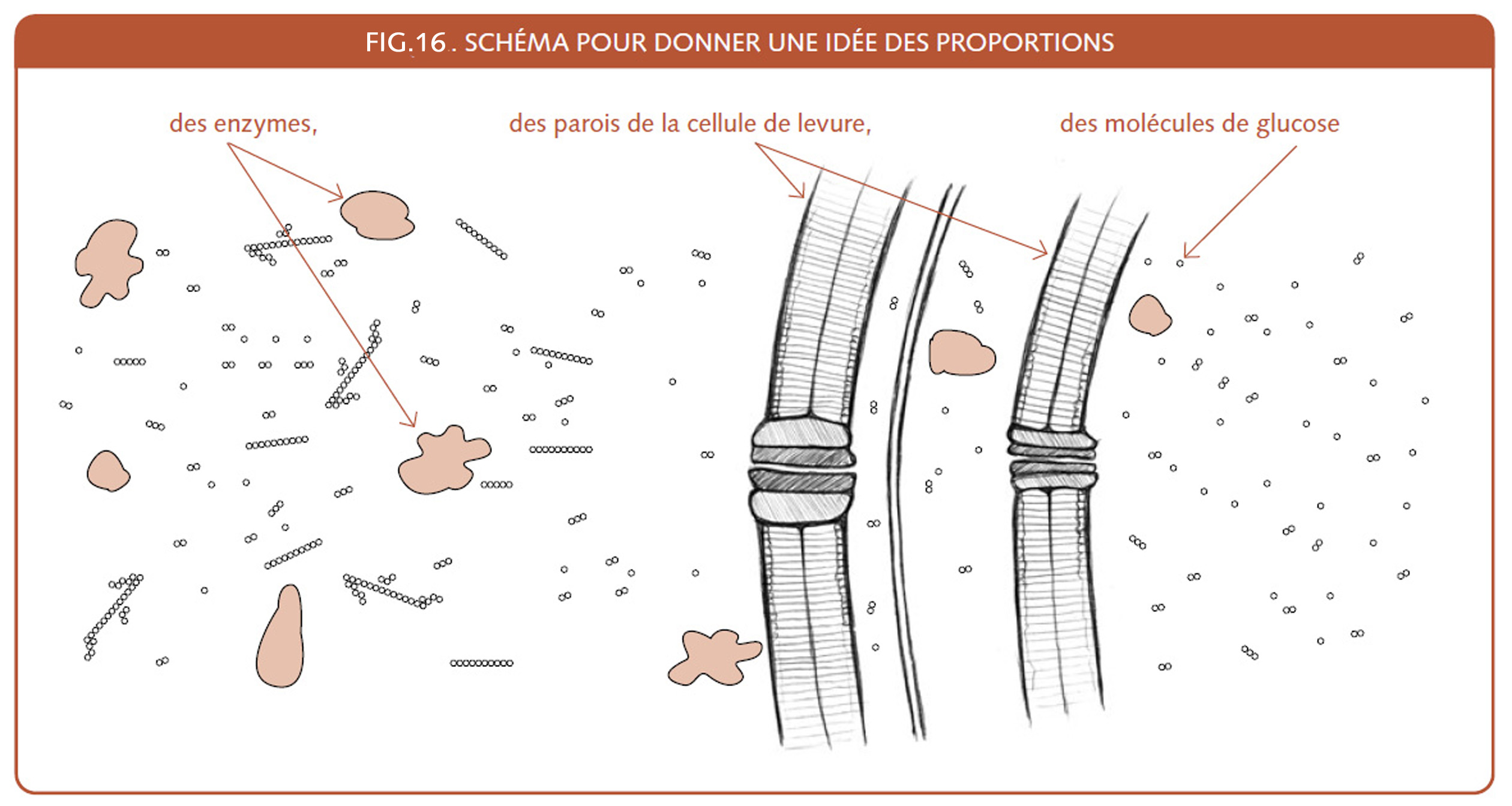
Comme pour l’humain, les microorganismes (agents de la fermentation panaire) ne savent assimiler qu’en petits morceaux la chaîne d’amidon, puisqu’ils ne savent faire entrer à travers leurs parois qu’une ou deux molécules de sucres « simples », mais pas de plus grandes tailles.
Reprenons ce que donne une « vue avec la loupe » pour définir l’action. Dans l’action des nombreux enzymes (fig.15 Dégradations enzymatiques), que l’on représente souvent en terme de ciseaux, il faut dire qu’elles n’ont pas toutes cette fonction de couper (ou dégrader) une grande chaîne de molécules en plus petites portions.
Nous aurons plus loin (XVI.10.3.2, XVI.11.2 et XVI.11.3), l’occasion de parler de ces autres fonctions, dites d’anabolisme, qui sont plutôt liantes que dégradantes en plus petites portions.
| fig.17. Les deux principales types d’activités enzymatiques au sein de la pâte | |
| Activité qui coupe les liaisons entre molécules
dite activité qui dégrade symbole utilisé |
Activité qui lie les molécules entre-elles
dite activité qui lie Symbole utilisé |
| Exemples :
Αlpha-amylase (*) ßéta-amylase (*) |
Exemples :
Transglutaminase (**) Estérase (**) |
| (*) enzymes natives du blé. (**) enzymes ajoutées ou exogènes du blé, souvent des enzymes recombinées (produit par un micro-organismes génétiquement modifiés : Mgm) | |
Les enzymes ont dans leur composition interne essentiellement des protéines solubles (VII.7 et XVI.4.6). À la différence des glucides (sucres) qui fournissent le combustible-énergie, ne détermine-t-on pas l’apport des protéines au niveau nutritif comme les « briques » ou bâtisseurs de notre corps et ici les enzymes ?
Les protéines solubles sont dites parfois protéines pour le métabolisme de la graine généralement impliquées dans le développement du grain et sa germination[170].
Point un peu plus difficile à comprendre, parce que pas toujours ou complètement explicable, l’enzyme sera codé (ou commandé) par les gènes. C’est l’« Adn » de l’humain qui commande les enzymes de notre corps et ce sont ces mêmes gènes de la plante ou du micro-organismes qui vont enclencher les processus enzymatiques pour la germination des plantes ou le cycle de reproduction des germes microbiens.
Pour toutes ces transformations, l’enzyme agit comme une serrure recevant une clé, le substrat (XVI.4.6) qui ouvrent la porte à la transformation enzymatique (fig.18).
La molécule enzymatique possède une zone bien précise (dite le site actif) dans laquelle vient s’emboîter le substrat. Depuis le xixe siècle, le concept serrure/clé d’é. Fischer (XVI.8) a évolué. En 1958, au laboratoire de Brookhaven près de New-York, Daniel Koshland expliquera que le site actif ou correspondent enzyme et substrat a moins la rigidité d’une serrure et d’une clef, mais plutôt la souplesse d’un gant (enzyme) dans lequel, entre la main (substrat). C’est l’« ajustement induit », comme on va l’appeler.
Prenons le cas (schématisé toujours) d’une molécule de substrat quelconque et de l’enzyme. À l’endroit de rencontre, entre l’enzyme et la molécule (le site actif), la fixation n’est possible que si cela correspond parfaitement ou très spécifiquement, comme une pièce de puzzle ou une clef dans une serrure. Alors l’opération enzymatique peut se réaliser, comme ici dans notre exemple ci-dessous, la molécule va se scinder en deux parties (fig.18, à gauche).
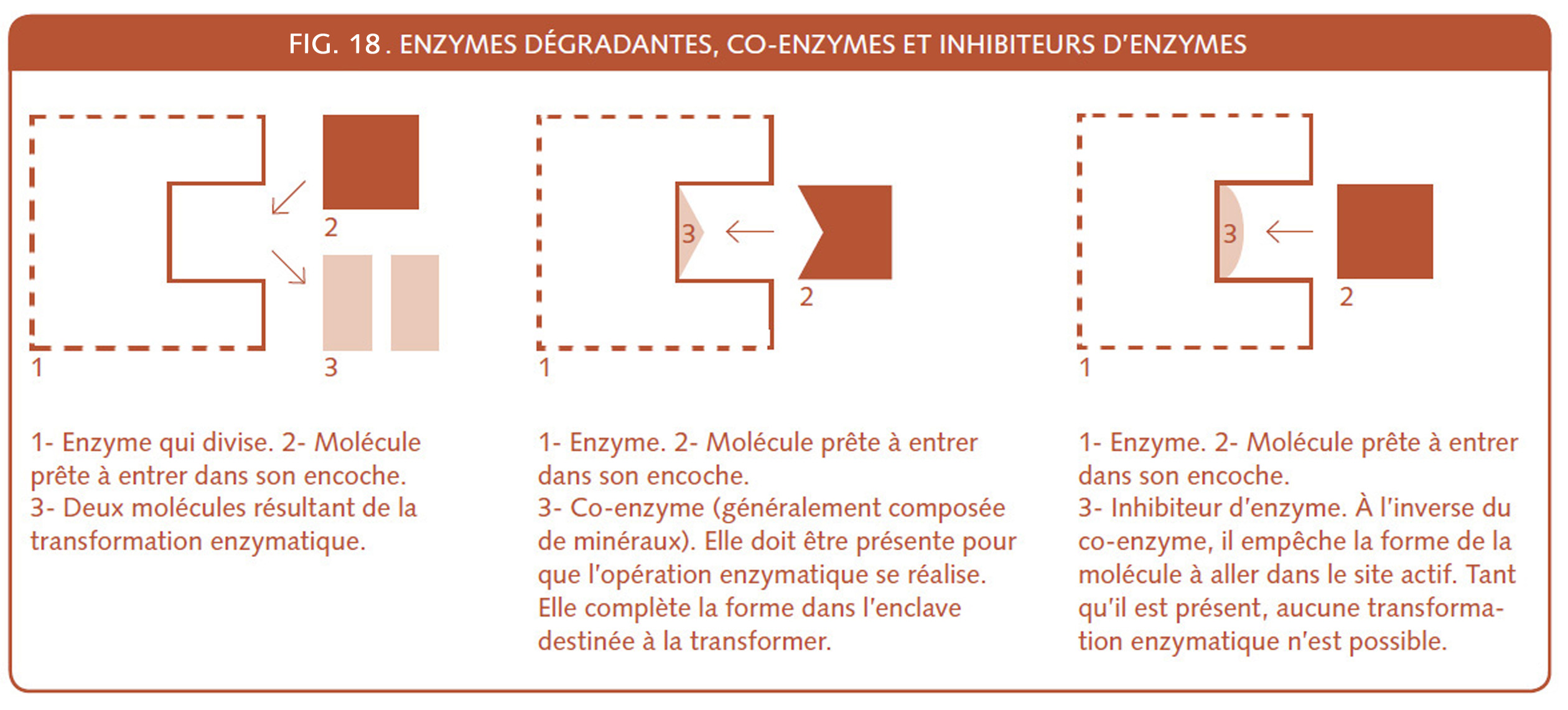
Aujourd’hui l’enzyme porte le nom de la molécule qu’elle transforme plus le suffixe -ase. Par exemple si les molécules sont une chaîne d’amidon, ce sera l’amylase, si elle agit sur des protéines, ce sera une protéase et si c’est des lipides, des lipases. Et ainsi de suite, pour les molécules plus petites, pentosanase pour pentosane, maltase pour maltose. Et toujours plus détaillé lorsque l’on arrive à retirer à la molécule, une molécule d’hydrogène c’est une déshydrogénase ou à faire muter un atome, au sein de la molécule, ce sera une mutase, etc.
Parfois pour que tout corresponde bien entre la serrure/enzyme et la clé/substrat, il faut qu’à la serrure s’ajoute un élément qui sera appelé co-enzymes, qui sont souvent des éléments minéraux (fig.18, au centre).
Les inhibiteurs d’enzymes installeront à l’inverse un obstacle entre la serrure/enzyme et la clé/substrat. À la place d’un élément qui aide à la complémentarité, c’est un élément qui empêche celle-ci (fig.18, à droite). Un inhibiteur d’enzymes contrecarre l’emboitement qui ne se réalise pas comme il se doit. Mais cet empêchement ne semble contrariant qu’au début de la fermentation (XVI.9.1.2). Il semblerait que l’activité de l’inhibiteur décroit assez vite lors de la vie fermentaire où l’activité enzymatique des enzymes natifs de la farine ajoutées à celles des micro-organismes de la fermentation panaire croit plus rapidement et de manière exponentielle.
On est parti du granule d’amidon et on n’a pas cessé d’agrandir notre champ de vision pour comprendre comment dans l’infiniment petit, une opération de dégradation se succède à une autre.
C’est une cascade de dégradations enzymatiques comme une chute de dominos dressés, pour reprendre encore une formule imagée, inspirée des auteurs allemands (Neu et Ransberger) spécialisés dans le soin de santé par les enzymes[171].
Cette « dégringolade » ou succession de dégradations est exponentielle en rapidité d’exécution.
Cette opération de dégradation enzymatique pourra recommencer parce que l’enzyme est inusable. La rapidité de transformation enzymatique est telle qu’il peut y avoir jusqu’à 10.000 actions en une minute[172]. Chiffre impressionnant qu’il faut relativiser en précisant que nous sommes là dans l’infiniment petit, dans l’échelle de la taille moléculaire, soit en dessous du 0,1 millièmes de millimètres (µm).
XVI.9.1.2. Les paramètres externes pour que l’enzyme soit fonctionnelle
Voyons maintenant les paramètres externes nécessaires à ces transformations enzymatiques. Toute cette « machinerie biologique » ira plus ou moins vite, suivant que les conditions sont optimales ou que l’on s’éloigne de celles-ci vers le haut ou vers le bas de ce point optimal d’activité.
Quelles sont ces conditions ? Il en existe plusieurs dont on décrit ici les cinq plus importantes.
En premier, il faut citer la température. Suivront les niveaux d’acidité, de pression osmotique (par exemple, perte de disponibilité d’eau par l’ajout de sel), la présence ou pas de co-enzymes et l’action des inhibiteurs d’enzymes.
Pour la température, il faut faire le lien avec la fièvre du à la chaleur du corps et le tremblement du au froid (XVII.4.1) que ressent tout milieu vivant. En cas de suspicion de maladie, on prend la température corporelle. Lorsque l’enfant arrive à 40 °C, l’alerte, voire la panique s’installent chez les parents. La molécule protéique qu’est l’enzyme du corps humain ne résiste pas souvent à de hautes températures, elle se transforme dans sa structure jusqu’à en devenir inactive. Une manière simple de comprendre ce changement de structure est d’observer la cuisson d’un blanc d’œuf composé essentiellement d’albumines qui sont des protéines solubles, le « matériel » dont est composé l’enzyme. On y observe facilement par la cuisson de l’œuf dans la poêle que de substance mucilagineuse, le blanc se fige dans une structure devenue déformée et solide. Il n’est plus possible dans une telle condition de coagulation qui modifie la structure, que la clé tourne dans la serrure. Mais attention, quand l’activité enzymatique devient inopérante, c’est le processus vital qui est menacé, d’où l’alerte dès les 40 °C., lorsqu’apparait une forte fièvre.
Dans la panification qui nous préoccupe, la température ne sera pas seulement celle prise à la fermentation, mais concerne aussi (voire surtout) le début de la cuisson (XXI.10). En effet la température d’activité optimale des enzymes amylases natives en panification est souvent supérieure à 50 °C – 55 °C. Le début de cuisson sera l’instant d’hyper-activité enzymatique pour cette raison. L’instant sera fort, mais court, puisque la température de désactivation (60 à 70 °C) n’est pas loin en durée de cet optimal dans le réceptacle qu’est le four chauffé à plus de 200 °C. C’est un peu comme battre la chamade avant l’extinction de la vie. Après dans la pâte, la texture de la mie se fige, avec la gélification de l’amidon (± 70 °C), et la coagulation des protéines (± 80 °C – XXI.10). Pendant quelques petites secondes, voire minutes, dans le four, les amylases pourront encore dégrader l’amidon gélifié, par exemple.
L’acidité est le deuxième paramètre influant sur l’activité des enzymes vu ici.
Le niveau d’acidité du milieu, souvent mesuré rapidement au pH, va lui aussi accélérer ou ralentir l’action de l’enzyme. Ici ce sera la fermentation qui influencera par sa durée et surtout par ses différents ensemencements. La fermentation levain donne un pH de 4 à 4,5, et la fermentation levure sera dans des pH vers 5,5 (IX.8). Chaque milieu mettra pour cette raison les enzymes, soit à l’aise, soit les embarrassera. Plus on sera vers l’acide ou vers le basique vis-à-vis de l’optimal d’activité de l’enzyme, plus l’efficacité de la réaction que l’enzyme engendre se réduira, comme pour la température. Généralement l’acidification a été utilisée de manière empirique dans la conservation des aliments, puisqu’elle va jusqu’à inhiber l’activité des ferments, donc des enzymes. Précisons qu’inhiber n’est pas tuer, mais mettre en veilleuse. Le levain de panification utilise d’ailleurs à certains moments de sa préparation cet effet conservateur-inhibiteur grâce à la lactofermentation qui acidifie plus fortement ce bout de pâte qu’est le levain-chef (XVII.8) par rapport au levain tout-point. Ce dernier est forcément bien plus actif, puisque se situant à des pH différents (pH parfois supérieur à 4,5) que celui du levain-chef qui est lui, jusque inférieur à pH 4.
Les différentes enzymes-amylases exogènes employées en termes d’ajouts en boulangerie auront aussi des zones d’optimum d’activité avec des pH différentes (XVI.10.2).
La pression osmotique est le troisième paramètre influant l’activité des enzymes présenté ici. Comme on sait aussi conserver certaines denrées par le sel (salaisons) et le sucre (fruits confits, confitures), cela nous permet de comprendre la pression osmotique. Le jambon subissant des salages successifs voit fortement se réduire l’activité enzymatique. Cela en devient un long « affinage » qui se réalise alors, et l’on nomme parfois celui-ci un peu pompeusement, phénomène « d’osmose ».
L’imprégnation progressive de sucre du fruit que l’on va confire va inhiber toutes activités aussi et c’est pour les mêmes raisons qu’une pâte de pain d’épices où le miel liquéfié remplace l’eau ne sait pas subir de fermentations comme la pâte à pain (XIX.3.4).
Trop de sucre ou trop de sel inhibe la fermentation, cela arrête ou freine celle-ci, mais ne tue pas forcément. Notons que parfois trop de glucose va jusqu’à protéolyser (là, détruire) les enzymes perméases[173], ces enzymes dont la fonction est de transférer les éléments de l’extérieur vers l’intérieur de la cellule de levure. Ce sont généralement des éléments minéraux qui agissent sur la pression osmotique. Les enzymes suivront les mêmes réactions que la levure (fig.9 dans XV.5), en fonction de la pression des éléments minéraux qui les environnent d’où en résultera un manque de disponibilité de l’eau. Celle-ci est nécessaire à une bonne activité enzymatique et est souvent évaluée par l’Aw ou la water activity en anglais. C’est la présence nécessaire d’humidité (ou teneur en eau) pour que la vie sache s’engendrer. Par exemple pour la conservation du grain de blé, on essaye de réduire le plus possible la teneur en humidité pour éviter que cette denrée ne se détériore par les microorganismes qui, eux, ont besoin de cette teneur en eau (VI.8). Pour le blé, l’activité exige une humidité minimale se traduisant par un Aw égal ou supérieur à 0,35 [174].
La présence de co-enzymes va influer aussi, ils ne sont pas « inusables » comme les enzymes, quoique en quantité importante, vu les proportions infiniment petites qui sont nécessaires. Les minéraux qui sont souvent les co-enzymes sont toutefois moins présents sur farines tamisées.
L’inhibiteur d’enzyme est un autre paramètre influant sur le milieu où l’enzyme s’exprime.
L’inhibition d’enzymes se comprend simplement. Dans la nature, le grain de blé pour devenir plante doit pouvoir se défendre afin que la réserve de nutriments qu’il contient en son sein serve uniquement à l’enclenchement de sa propre germination.
Ainsi les amylases ne provenant pas de la plante (par exemple ceux de microorganismes et de prédateurs primaires, charançons et mites), ont à faire face à ce système de défense des plantes, dans un premier temps.
Comme le grain doit pouvoir se défendre afin de donner une plantule puis l’épi, des éléments bloqueurs d’activité des enzymes, seront présents. Ils sont composés de protéines solubles de blé (de même origine que les enzymes) et ils « possèdent un pouvoir inhibiteur vis-à-vis des α-amylases ne provenant pas de la plante[175] ». Cette « action anti α-amylasique s’exerce contre les amylases salivaires, pancréatiques et bactériennes, ainsi que celle de divers insectes », par exemple les coléoptères, charançons du grain et les lépidoptères, mites de la farine (VI.5)[176]. L’action des inhibiteurs d’enzymes « correspond sans doute à un rôle de défense de la plante contre les insectes » écrit Yves Dacosta[177].
Ces inhibiteurs d’enzymes ne seraient pas trop préoccupants dans la panification pour autant que celle-ci opère une bonne fermentation qui ferait perdre sa défense inhibitrice aux inhibiteurs venant du grain de blé. Dans les conditions de fermentation, en général, la force de désactivation des inhibiteurs d’enzymes décroît très vite et inversement la force d’activation des enzymes va augmenter et occuper l’espace. C’est du moins ce qui a été constaté lors de la germination de semences de laitue[178].
Voilà pour l’explication de l’action des principaux paramètres externes influant de l’action enzymatique.
XVI.9.2. Cours préliminaires sur les substrats des enzymes
XVI.9.2.1. Les substrats glucides
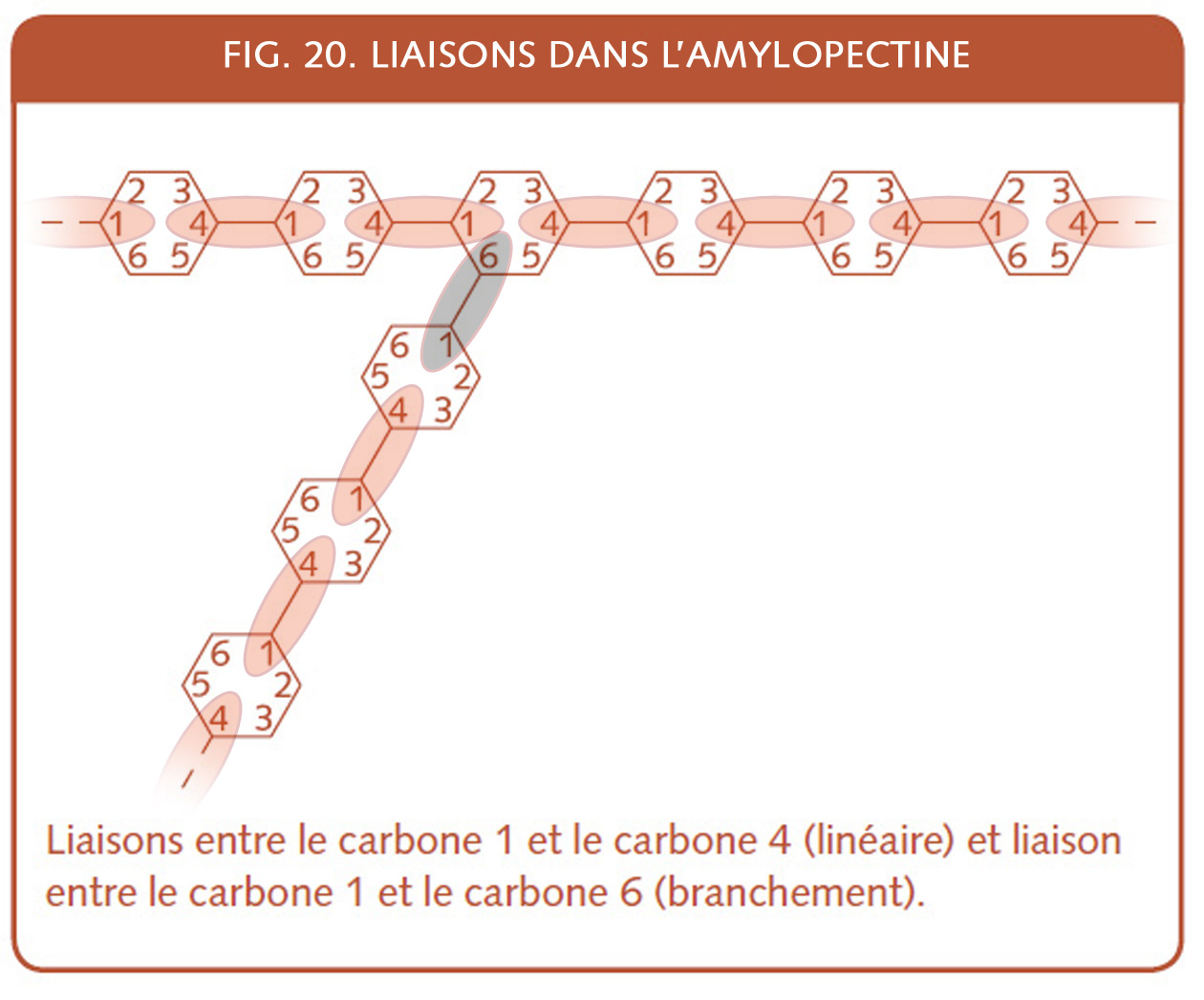 Dans cette deuxième partie explicative, il est nécessaire pour nous qui voulons mieux comprendre la vie intime d’une pâte, de savoir qu’une farine est composée notamment de glucides ou hydrates de carbone que l’on se contente souvent d’appeler « sucres » au pluriel. Mais il faut en effet savoir, pour pénétrer un peu plus la compréhension de l’activité d’une pâte, qu’un sucre n’est pas l’autre.
Dans cette deuxième partie explicative, il est nécessaire pour nous qui voulons mieux comprendre la vie intime d’une pâte, de savoir qu’une farine est composée notamment de glucides ou hydrates de carbone que l’on se contente souvent d’appeler « sucres » au pluriel. Mais il faut en effet savoir, pour pénétrer un peu plus la compréhension de l’activité d’une pâte, qu’un sucre n’est pas l’autre.
On a déjà parlé (VII.5) des sucres simples (ou sucres rapides) et des sucres complexes (lents), nous pouvons garder le même ordre pour en parler en analyse plus approfondie avec les termes qu’emploie la science.
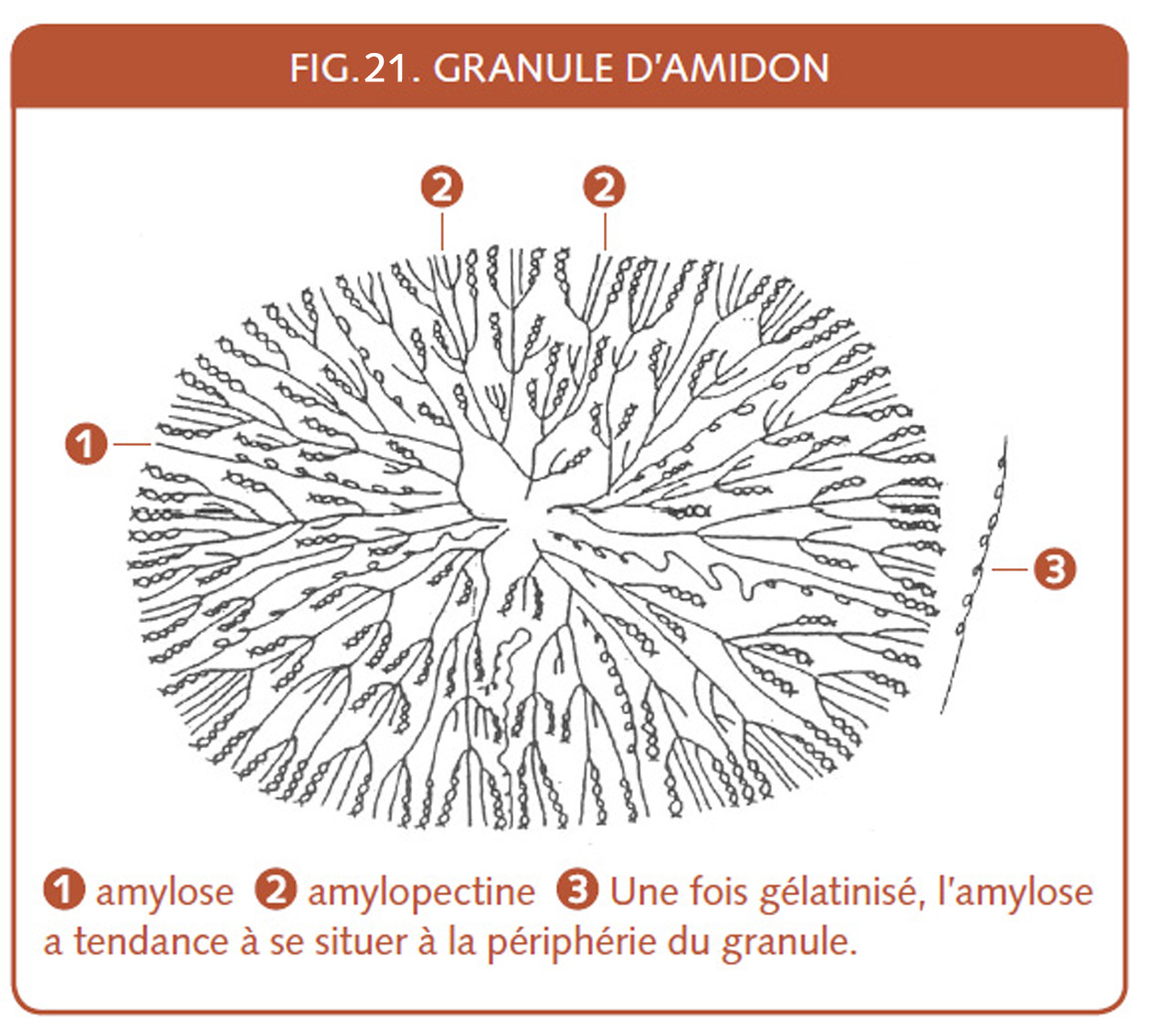 Le sucre complexe dans la farine est l’amidon. C’est une chaîne de molécules de glucose liées une à l’autre (fig.4 dans VII.5, fig.21 de ce chapitre). Mais toutes ces liaisons entre les molécules ne sont pas les mêmes, elles se font en différents endroits.
Le sucre complexe dans la farine est l’amidon. C’est une chaîne de molécules de glucose liées une à l’autre (fig.4 dans VII.5, fig.21 de ce chapitre). Mais toutes ces liaisons entre les molécules ne sont pas les mêmes, elles se font en différents endroits.
Certains endroits où se relient les molécules entre elles sont différents au point de donner la possibilité de donner deux liens sur une molécule de glucose pour continuer les chaînes d’amidon. Un lien continue la ligne droite et l’autre va permettre un branchement.
L’un des liens, établi entre le carbone 1 d’une molécule de glucose et le carbone 4 de l’autre molécule de glucose, est dit 1,4. L’autre lien, celui du démarrage du branchement, se réalise entre le carbone 1 de la molécule glucose de l’autre branche avec le carbone 6 de la même molécule ; on le dénomme liaison 1,6 (fig.20).
En fort schématisé, le granule d’amidon cela donne à peu près ceci (fig.21).
La majorité de l’amidon du froment est composé de chaînes d’amidon à branchements (ou ramifications). On en compte en son sein jusqu’à 70 %. Elles se dénomment amylopectines, du fait qu’elles ont des qualités épaississantes plus fortes que les chaînes linéaires sans branchements (les 30 % restants) qui sont elles, appelées, amyloses.
Certaines variétés d’autres céréales que le froment ont des compositions à plus forte teneur en amylopectine. C’est le cas d’une variété de riz, dit à tort « glutineux » en français, « waxy » en anglais (X.14). Mais on le traduit mieux on disant « riz collant » ou avec une expression moins appétissante « riz gluant ». En fait, malgré la première appellation « riz glutineux », il ne contient pas de gluten. Quoiqu’il en soit, ce « gluant » ou « collant » serait dû au fait que l’amylopectine domine, presque en totalité, dans l’amidon de ce riz et l’amylose est pratiquement absente (il n’y en a que 0 à 2 %).
Une fois que la chaîne d’amidon se dégrade en plus petites portions, ces dernières vont porter la dénomination générique de dextrines. L’expression « dextrines limites » elle, est employée pour spécifier le fait que les amylases natives de la farine ne savent pas « débrancher » ou plus précisément ne savent pas séparer les molécules d’amidon accolées entre elles par la liaison (dites 1,6) permettant le développement de ramifications. Ce qui fait que l’opération des enzymes (ici dégradation qui coupe en plus petites portions) s’arrête à la proximité de ces branchements, c’est leur limite, l’échelon butoir, en quelque sorte.
Les dextrines (ou molécules de glucose accolées l’un à l’autre), qui comptent de plus petits nombres de molécules que l’amylose, s’appelleront avec encore plus de précision :
- maltose (2 molécules liées entre elles),
- maltotriose (3 molécules liées entre elles),
- maltotétraose (4 molécules liées entre elles),
- maltopentaose (5 molécules liées entre elles),
- maltohexaose (6 molécules liées entre elles).
Après la précision apportée sur les sucres complexes, venons aux sucres simples.
Encore que cette appellation « simples » peut faire l’objet de diverses interprétations, puisque le maltose et autres disaccharides (deux molécules d’hydrates de carbone liées entre elles) sont souvent déclarés sucres simples du fait qu’ils sont assimilables par divers organismes digestifs. Pour mieux connaître les sucres dits simples d’une seule molécule, il faut passer une autre étape d’approfondissement du langage scientifique. On devra parler non seulement de molécule, mais aussi des atomes qui composent cette molécule.
Plusieurs expressions ont été employées pour dénommer les « sucres » de la farine, nous retiendrons ici la plus scientifique « hydrate de carbone ». Hydrate pour les atomes d’hydrogène et carbone pour les atomes de carbone évidemment.
Une molécule d’hydrate de carbone, soit …ose en terminaison du nom, peut avoir 6 atomes de carbone (hexose) ou 5 atomes de carbone (pentose).
Schématisé encore une fois, cela donnera un hexagone ou un pentagone d’hydrates de carbone (fig.22). À chaque angle de la figure 20 se situe un atome de carbone (ici numéroté de 1 à 6).
Ce n’est qu’avec des dessins en 3D que l’on peut voir que ces molécules pivotent pour réaliser la jonction à l’atome de carbone voulu. Les dessins à plat (fig.23) peuvent dès lors être trompeurs.
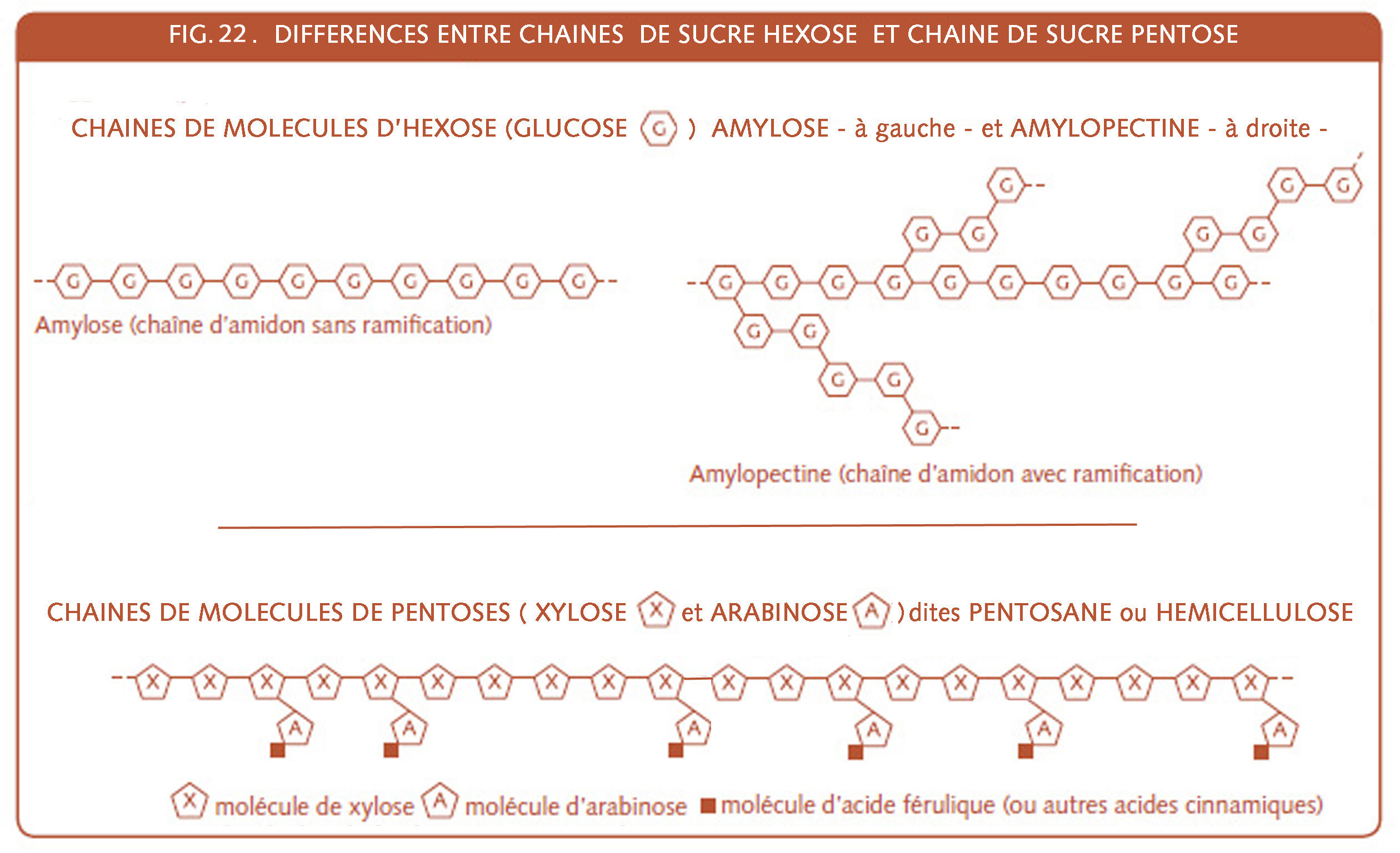
Maintenant, vous savez déjà différencier les hexoses, des pentoses.
Mais, il existe différents hexoses et différents pentoses.
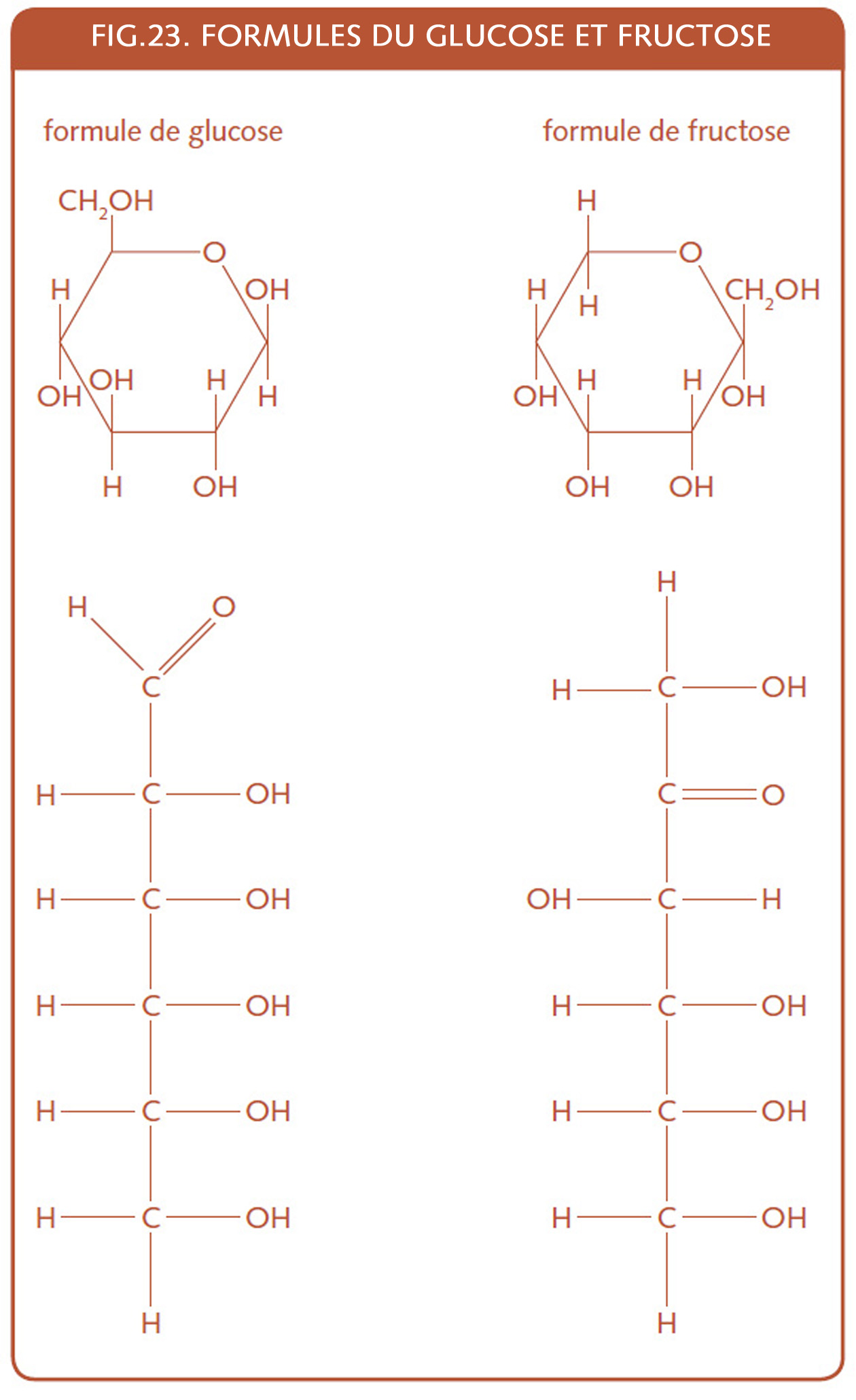 Le glucose, le fructose et le galactose sont des hexoses et se différencient dans la position des atomes de carbone, d’hydrogène et d’oxygène au sein de la molécule d’hydrates de carbone. Pour l’explication de cette différence, il est nécessaire de passer par les formules plus « chimiques », couchée sur papier, ce sera comme une mise à plat (fig.23.).
Le glucose, le fructose et le galactose sont des hexoses et se différencient dans la position des atomes de carbone, d’hydrogène et d’oxygène au sein de la molécule d’hydrates de carbone. Pour l’explication de cette différence, il est nécessaire de passer par les formules plus « chimiques », couchée sur papier, ce sera comme une mise à plat (fig.23.).
La molécule de glucose compte 24 atomes, qui en formule réduite donne C6H12O6, soit 6 atomes de carbone (C), 12 atomes d’hydrogène (H) et 6 atomes d’oxygène (O).
La composition de la molécule de fructose (qui portait aussi le nom de « lévulose ») est C6H12O6 aussi, et se dénomme ainsi parce que ce type de sucres est présent principalement dans les fruits. Pour comprendre la différence entre le glucose et le fructose en langage scientifique, il s’agit simplement d’un changement de position d’atome au sein de la molécule. Cela s’appelle un isomère, que l’on traduit du grec par « partie identique ».
Pour savoir ce qui résulte du changement dit d’isomères, il faut savoir que c’est ce qui permettra dans les années 1970 aux États-Unis, une fois un procédé enzymatique trouvé, de produire le fameux « High Fructose Corn Sirop » -Hfcs, à partir du maïs. Dont la teneur peut être variable, jusqu’à 90 % fructose / 10 % glucose utilisé en pâtisserie, soit le plus utilisé des Hfcs, les 55 % / 45 %. Ce qui remplacera progressivement le sucre de canne dans les sodas en Amérique du Nord, puis globalement dès 1984. Il existe encore du Hfcs en proportion de 42 % / 58 % utilisé dans les boissons isotoniques – à boire après l’effort, à ne pas confondre avec les boissons énergisantes.
Ce remplacement du sucre par l’isoglucose (autre nom du Hfcs), s’est réalisé grâce à la découverte d’une enzyme. Elle a pu être une réalité suite à une situation économique spécifique des deux grands États de l’Amérique du Nord qui étaient excédentaires en maïs et en pénurie de sucre de canne. Cela deviendra assez vite la cible de campagne diététique, où diabète, obésité et risque cardio-vasculaire sont les principaux reproches adressés à sa surconsommation, comme pour tout excès de sucre (VII.5).
Cette « saga économico-diététique » nous éloigne quelque peu de la boulange.
Revenons aux sucres simples d’une à deux molécules. Ils sont peu présents dans la farine. Mais cela suffit pour nourrir les voraces levures ou mieux dit encore la microflore des levains lors des rafraîchis de levains. Les chiffres que l’on possède sur le % de ces sucres viennent souvent de quelques études assez anciennes. De ce fait, on reprendra l’inventaire le plus récent qui donne 0,1 % de glucose , 0,1 % de fructose, 0,5 à 2,3 % de saccharose et de 0,1 à 0,3 % d’autres sucres. En moyenne 1,7 % au total[179].
 Dans cet inventaire des sucres directement fermentescibles, plusieurs sont composés de plus d’une molécule (monosaccharide). Ainsi, il existe plusieurs disaccharides composé de deux molécules de sucres (fig.4 dans VII), c’est le cas des :
Dans cet inventaire des sucres directement fermentescibles, plusieurs sont composés de plus d’une molécule (monosaccharide). Ainsi, il existe plusieurs disaccharides composé de deux molécules de sucres (fig.4 dans VII), c’est le cas des :
- maltose (2 molécules de glucose liées entre elles),
- tréhalose, même composition que le maltose, mais avec une liaison différente.
- saccharose (1 molécule de glucose liée à 1 molécule de fructose),
- lactose (1 molécule de glucose liée à 1 molécule de galactose).
- mélibiose, même composition que le lactose, mais avec une liaison différente.
Ou encore de plus de 2 molécules.
- le raffinose par exemple a 3 molécules : 1 molécule de galactose liée à 1 molécule de glucose et 1 molécule de fructose.
On s’arrête là avec les appellations, et on « ose » facilement le faire, car l’important n’est pas de connaître toutes ces dénominations, mais de savoir que chacun de ces sucres a des propriétés et des goûts bien distincts. Le goût maltose n’est pas le goût glucose, par exemple. En plus ce que l’on veut signaler ici, c’est de savoir que les opérations séparant ces liaisons entre molécules de glucose et autres seront opérées par des enzymes à chaque fois spécifiques. Cette notion est importante pour pénétrer l’esprit et les limites des actions de l’ingénierie enzymatique vues plus loin, mais aussi, pour comprendre d’autres curiosités de la vie naturelle d’une pâte.
XVI.9.2.1.1. La dégradation de la molécule de glucose par voies fermentaires
Nous devons évoluer dans notre connaissance de la dégradation de la molécule de glucose à l’intérieur du microorganisme (d’où le terme d’endoenzymes utilisé). Ces dégradations étant opérées par les trois voies fermentaires du glucose qui existent dans la fermentation au levain.
Les descriptions succinctes vont nous permettre d’approfondir les changements du nombre et des changements de positions d’atomes au sein même de la molécule d’hexose (de six atomes de carbone) qu’est le glucose qui devient transformé en :
- Deux molécules de triose composées chacune de trois molécules de carbone, cela après division lors de la fermentation au sein des microorganismes.
Ce travail enzymatique produit au final des dégradations dénommées métabolites terminaux.
- Soit 1 molécule d’atome de carbone lié à 2 atomes d’oxygène, le fameux CO² ou gaz carbonique, occasionnant l’aération de la mie, dit les « yeux du pain » par les anciens.
- Soit des molécules d’acide lactique comptant 3 atomes de carbone
- Soit des molécules d’acide acétique qui, elle, ne compte que 2 atomes de carbone
- Soit une molécule d’alcool qui a aussi 3 molécules de carbone.
Ce sont les molécules terminales de ces trois voies fermentaires du levain réalisées par les microorganismes du levain qui sont citées là. Toutes les molécules intermédiaires seront évidemment moins présentes dans la pâte à pain que ces molécules terminales de ces trois voies fermentaires.
Avec raison, certains diront : mais c’est de la biochimie ! Et qu’ils ne s’attendaient pas à devoir connaître cela pour être boulanger(e).
En fait, il est seulement question d’approfondir et mieux comprendre la fermentation et pour cela être curieux, découvrir, apprendre est une bonne chose.
C’est donc dans une optique « on n’en sait jamais assez » que se lit cette figure 25. Sachez que les noms de molécules ne sont pas à retenir par cœur pour passer un examen, mais que ces voies fermentaires expliquées ainsi, m’ont fait quant à moi comprendre que pas mal de molécules intermédiaires ont des propriétés volatiles et aromatiques qui apportent un parfum naturel à la mie. Du coup je me suis retrouvé fervent défenseur de la phase fermentation dans la panification, j’en ai fait une priorité et j’en ai oublié et même éviter le dégazage.
La compréhension pour une meilleure régulation des acides produits et la recherche d’équilibre entre le spiritueux de la fermentation alcoolique et l’acide de la fermentation lactique sait également mieux s’imaginer avec l’explication des voies fermentaires. Un autre équilibre à rechercher se situe dans la balance entre les acides lactique et acétique, où la compréhension s’échafaude mieux aussi, grâce à cette figure 25.
La dénomination de voie hétérofermentaire plutôt que fermentation des bactéries lactiques hétérofermentaires a retenu ma préférence, puisque la même bactérie suivant les sucres (pentoses ou hexoses) qu’elle va fermenter aura la possibilité d’avoir deux voies différentes de fermentation.
À gauche de la fig.25, est présentée la voie de la fermentation dite de la glycolyse (étymologiquement, scission du sucre) qui va de la molécule de glucose à l’acide pyruvique. À partir de ce stade de l’acide pyruvique, la voie de la fermentation alcoolique des levures va encore réaliser deux transformations qui dégageront, pour la première, le gaz carbonique (CO²) et pour la deuxième, l’alcool.
Au centre de la fig.25, la voie de la fermentation lactique homofermentaire (c.à.d. qui ne produit que l’acide lactique) va de la même manière de la molécule de glucose aux deux molécules d’acide pyruvique (c.à.d., la glycolyse), mais comme les bactéries lactiques n’ont pas les mêmes enzymes que la levure, il en résultera une transformation de l’acide pyruvique en acide lactique.
À droite de la fig.25, la voie hétérofermentaire, est différente, elle n’utilise pas le chemin de la glycolyse des voies alcoolique et lactique homofermentaire et produira une molécule d’acide acétique et à partir de l’acide pyruvique une molécule d’acide lactique, d’où le terme ; fermentation hétérofermentaire.
Ici, interdit d’être fatigué si vous vous essayer à la lecture, accrochez-vous, relisez plusieurs fois le chapitre au besoin et si vous êtes au fournil, n’oubliez pas de mettre une minuterie de rappel, car il vous faut de la concentration pour suivre le propos.
XVI.9.2.3. Les substrats pentoses
Après la dégradation détaillée du sucre hexose qu’est le glucose, on passe à la dégradation des sucres pentoses. Eux se situent près de l’enveloppe du grain, généralement dans la couche d’aleurone, c’est là qu’ils se concentrent. Ils entreront dans la fermentation de la voie hétérofermentaire à l’étape 4 de la ribulose.
Pour ce qui est du seigle, « on retrouve 30 % des pentosanes du grain dans l’amidon, les 70 % restants se trouvent dans les enveloppes[180] ». Ce type de sucres a des propriétés épaississantes et gélifiantes. C’est dans d’autres graines que le froment, soit dans le seigle, l’orge, l’avoine qu’ils sont plus présents.
Ces chaines de sucres pentoses sont composées de molécules dite de xylose en ligne (X dans un pentagone) sur laquelle se greffent des molécules d’arabinose (A dans un pentagone). Une petite présentation est faite dans la figure 12 du chapitre IX qui mentionne également l’appendice des acides féruliques et leurs potentialités de liaisons.
La récente mise en valeur de leurs propriétés et la multiplicité d’interventions enzymatiques, font qu’on les approchera plus loin aux chapitres XVI.10 et XVI.12.
Après l’approche des termes scientifiques des glucides de la farine ( hexoses et pentoses), passons aux protéines (fig.19)
XVI.9.2.4. Les substrats protides
Les protéines (ou matières azotées) ont le même profil d’enchainement que les glucides.
Ce sont des chaines de molécules (ici d’acides aminés contenant des éléments N-azote, dits aminés) qui au niveau du processus d’assimilation digestif devront se dégrader ou se séparer l’une après l’autre. Toutefois, il y a des différences importantes au niveau structure de ces chaines, que nous verrons de manière plus approfondie plus loin (XVII.3).
Un point qui différence les protides (protéines) des glucides (sucres) lors des transformations enzymatiques, c’est que les protéines ont non seulement la faculté de se scinder en portions toujours plus petites, mais aussi de recréer des liaisons, bien plus que les glucides et ainsi former d’autres types d’associations de molécules protéiques.
C’est ce qui est souvent recherché par le boulanger, cela donne notamment une plasticité et permet mieux l’aération de la mie. Les « liens » ou « pontages » entre chaînes protéiques donnent un « nerf » à la pâte.
Nous avons déjà vu (fig.9 dans VII.7) qu’il existe une vingtaine d’acides aminés alimentaires et que ceux-ci ont tous une spécificité différente.
De plus, certaines spécificités (polarité) ne sont pas les mêmes technologiquement dans un environnement levure ou un environement levain aux teneurs en potentiel d’hydrogène (pH) distincts (fig.13 dans IX).
Dans les acides aminés, il y en a qui n’aiment pas trop l’eau (ils sont dits ; hydrophobes) et dans le milieu aqueux qu’est la pâte, en se regroupant ou réfugiant ensemble à l’intérieur d’une chaîne d’acides aminés (peptides, mais surtout protéines) ils feront faire un mouvement (ou forme différente de structure) et même un réarrangement (déplacement) dans l’ordre qui était établi entre eux avant l’arrivée de l’eau. Cela sera vrai aussi pour les autres acides aminés qui ont d’autres caractéristiques, les acides aminés soufrés (cystéine et méthionine, principalement (figures 9 et 10 du chapitre VII.7) seront aptes à établir des liens (ponts disulfurés) dans la chaîne même, ou entre deux chaînes de protéines différentes.
Les acides aminés aimant l’eau (dits hygrophiles) ont aussi des fonctions particulières, ce sera parfois à leur emplacement dans la chaîne que s’opèreront plus facilement les coupures dans la chaine de gluten ou protéines.
Enfin n’oublions pas de sortir du technologique et entrer dans le nutritionnel avec les acides aminés qui sont dits essentiels quand ils doivent venir par l’apport alimentaire. Le problème en panification est que ceux qui sont intéressants technologiquement ne sont pas si avantageux nutritionnellement. Exemple, les composants du gluten sont moins intéressants en termes d’efficacité protéique nutritionnels (de la fig.9 à la fig.12 dans VII.7).
Les enzymes protéases savent donc dégrader les chaines d’acides aminés en petits morceaux et en même temps des liaisons peuvent s’opérer par un autre processus enzymatique, pour les ponts disulfures et d’autres liaisons.
Nous verrons plus loin (XVI.10.3) l’action de protéases natives de la farine et, (XVI.11.3), l’action que peut proposer l’ingénierie enzymatique.
XVI.10. Les enzymes natives et leurs actions au sein de la farine et la pâte.
XVI.10.1. Les lipases natives
Après les glucides et les protides, passons à la compréhension des divers lipides (graisses) du blé, qui sont aussi des chaînes de molécules dont nous avons déjà vu les spécificités schématisée (fig.2 de XVI.4.4).
Longue chaîne, à la fois plus fluide, se dégradant plus vite, les lipides de la farine font souvent débat. Simplement par le fait que leur présence naturelle dans une céréale comme le froment est minime, surtout dans l’amidon, d’où parfois (à tort) on a défini leur rôle comme insignifiant[181].
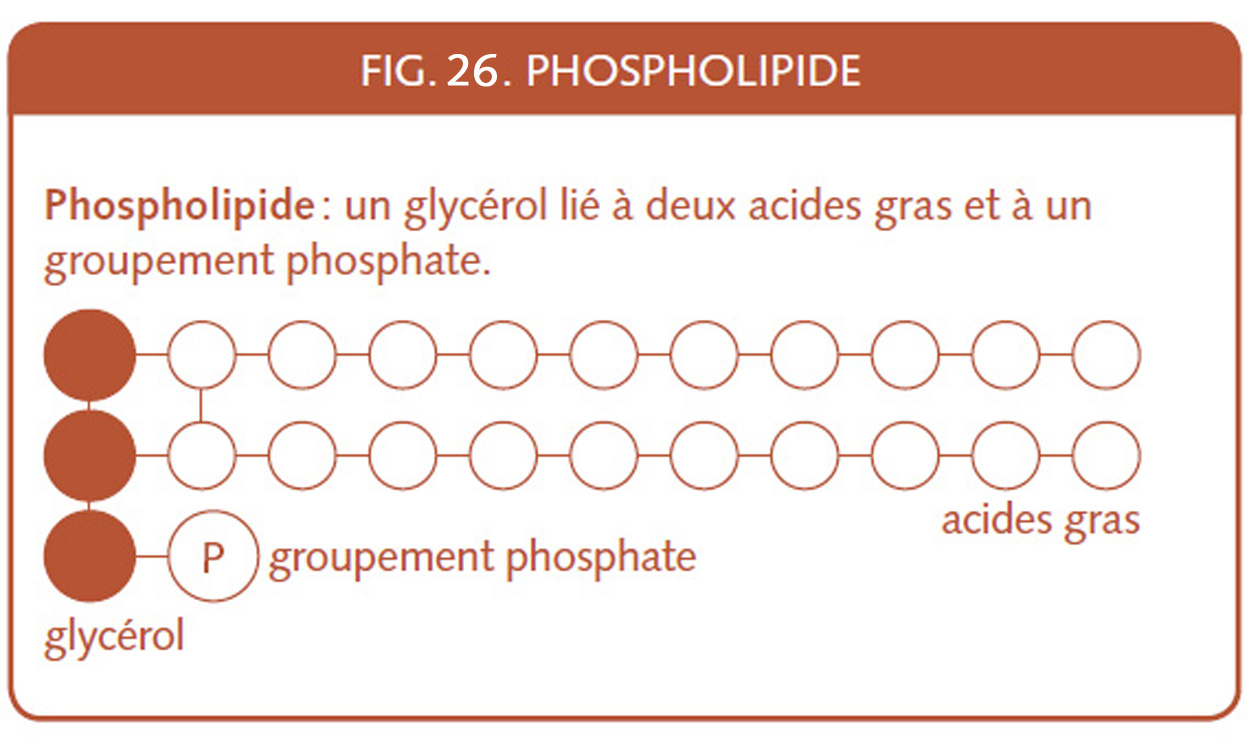 Mais nous allons le voir par après, ce faible pourcentage d’acides gras a son importance.
Mais nous allons le voir par après, ce faible pourcentage d’acides gras a son importance.
Voilà la représentation d’une chaîne de phospholipides (fig.20) , présente naturellement dans le grain de céréale.
On entre dans ce sous-chapitre comme dans un des buts de ce livre, puisqu’il nous permet de mieux connaître la pâte témoin.
Essayons d’approcher au mieux ce que l’on souhaite être la référence du jugement : la dégradation enzymatique « native » de la farine. Connaître mieux qui fait quoi dans la pâte.
Nous allons voir qu’au départ ce sont les enzymes de la farine qui sont actives et plus loin dans le processus de fermentation de la pâte, ce sont les enzymes des micro-organimes.
Connaitre le rôle de chaque intervenant, est une compétence professionnelle.
Instruire le sujet, c’est surtout bénéfique pour en apprendre plus sur le parcours d’une panification naturelle et le choix de l’auto-fermentation, au levain naturel.
C’est l’occasion de mieux respecter cette vie naturelle d’une pâte par des méthodes de panification naturelle, comme le prescrit le décret du pain français de tradition et ce qui est clairement un des objectifs de ce livre.
| fig.27. La vie s’amorce grâce à ces éléments du grain
Teneur en éléments plus vitalisant et souvent plus bio-disponibles contenu dans le germe, et son scutellum ainsi que dans la couche d’aleurone |
|
| Éléments vitalisants | Contenu du germe et son scutellum ainsi que contenu dans la couche d’aleurone |
| Vitamine B 1 | 60 à 70 % de la vitamine B1 contenues dans le grain se situe dans ces deux parties, (VII.9.) |
| Protéines déjà solubles | Ces deux parties du grain contiennent 30 à 40 % de protéines solubles .
Alors que le grain dans son entièreté n’a que 15 à 20 % de protéines solubles, (VII.7.). |
| Sucres directement disponibles | Ces deux parties du grain contiennent 10 % de sucres directement assimilables
Alors que pour l’ensemble du grain, il n’y a seulement 1 à 1,5% de sucres directement assimilables, (VII.5.). |
| Lipides naturels se dégradant par simple oxydation | 14 % des lipides du grain se localise dans le germe et son scutellum. Tandis que c’est 24 % des lipides contenus dans le grain qui se situe dans la couche d’aleurone, (VII.8.). |
| Minéraux disponibles dans un deuxième temps | 9,1 % des minéraux du grain se localise dans le germe et son scutellum. Tandis que c’est 48,4 % des minéraux contenu dans le grain qui se situe dans la couche d’aleurone, (VII.10.). |
| D’après WILLM, 2005 et ANTOINE et al., 2003. | |
Les premières enzymes actives de la transformation boulangère des céréales sont les lipases, celles qui dégradent les graisses.
La plante « blé » possède bien sûr ses propres enzymes que l’on qualifiera de végétales ou natives. Dans leurs fonctions premières ( redonner un nouvel épi grâce à la semence ), celles-ci dégraderont petit à petit les composants (lipides, glucides, protides et micronutriments) pour amorcer la vie, dès que les conditions (chaleur et humidité ambiantes) seront en place.
La dégradation enzymatique démarre logiquement à partir du germe et de sa périphérie ainsi que de la couche d’aleurone qui sont les endroits du grain les plus riche en nutriments directement vitalisant (fig.27 et fig.29).
Le germe a une bonne teneur en nutriments. Il est réputé comme principal représentant de la teneur en vitamines B et vitamine E ; avec son scutellum (partie périphérique du germe), il contient 60 à 70 % des vitamines B1 du grain. La teneur en protéines du germe est de 30 à 40 % sur matières sèches et de 5 à 6 % d’éléments minéraux[182] .
Le germe ne faisant que 3 % du grain contient près de 14 – 15 % de lipides du grain de blé.
La couche d’aleurone, 8 % du blé, prend 24 % des lipides du grain de blé. Comparativement, l’albumen amylacé, l’amande, 84 % du blé, n’a que 62 % des lipides totaux du blé[183].
C’est important de bien situer les nutriments, si l’on veut travailler sur les forces du blé au niveau de sa vitalité.
XVI.10.1.1. La prime-action des lipases dès la mouture
Revenons aux enzymes lipases et à leur substrat, les lipides ou graisses. Ces derniers sont en effet les matières du grain le plus facilement décomposables. Ce qui va permettre après l’hydrolyse, une action enzymatique oxydative des protéines afin d’obtenir la « maturité de la farine[184] », (XVI.10.3.2 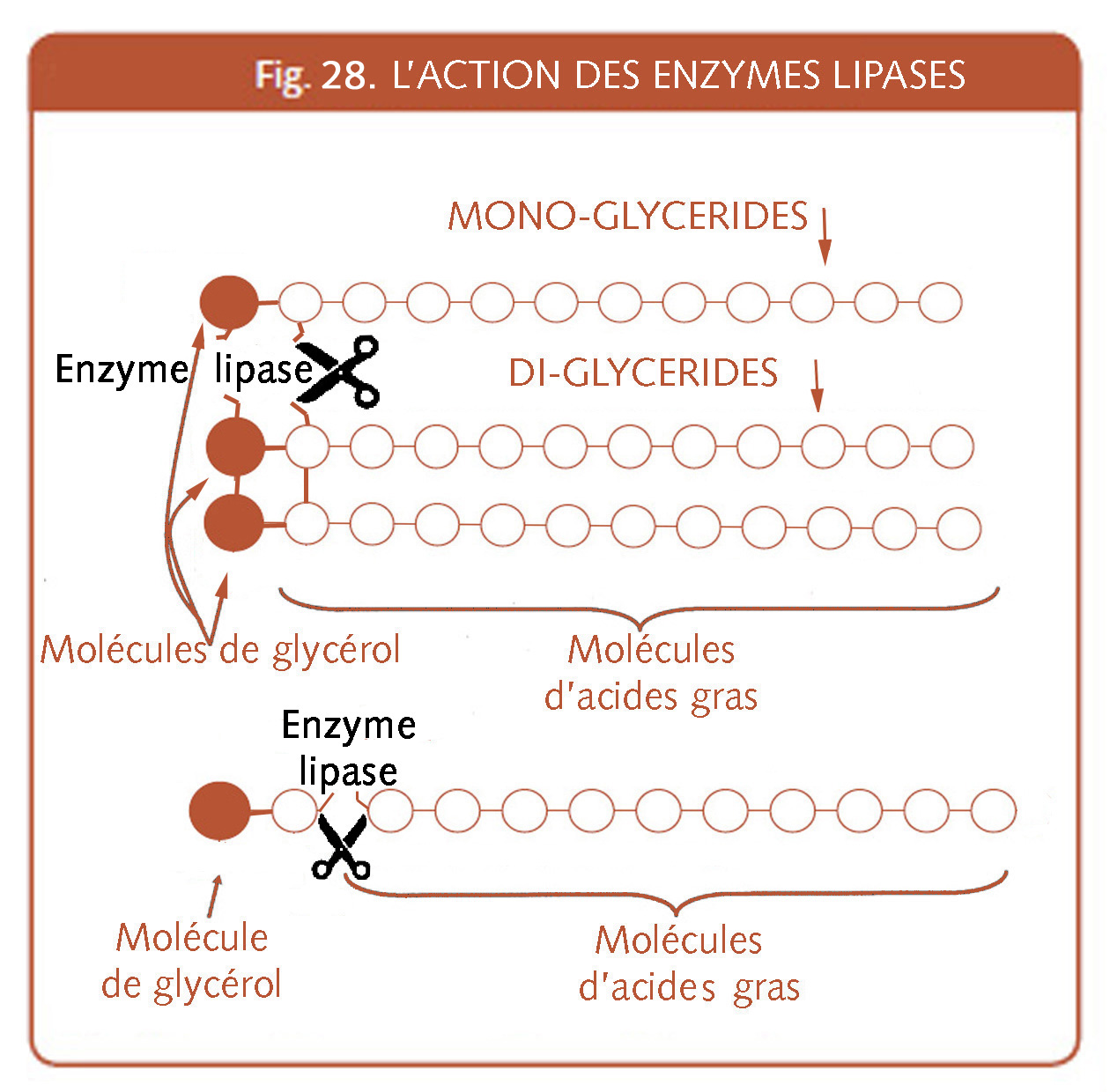 et fig.13 dans XII.8).
et fig.13 dans XII.8).
En effet, bien avant le mélange avec l’eau et le ferment au pétrissage, dès la mouture et la simple conservation de la farine (particulièrement la farine complète, comportant le germe), les lipases sont pratiquement les seules enzymes hydrolases en activité dans le milieu encore sec. Il faut savoir que dans la farine et par la faible teneur en eau de celle-ci, les probabilités de rencontre entre molécules sont plus limitées.
Deux types d’enzymes lipases peuvent agir, soit en séparant les chaînes de glycérides entre elles, par exemple quand une chaîne de tri-glycérides se scinde en une chaîne de mono-glycérides plus une de di-glycérides, soit en coupant à l’intérieur de la chaîne d’acides gras pour libérer ceux-ci (fig.28).
Afin d’avoir un repère simple de ce phénomène de dégradation (hydrolyse enzymatique), dans un premier temps (quelques semaines) on attribuera à l’action enclenchée par les lipases et celles des oxydases qui s’enchaîneront après, la maturation de la farine (appelée aussi « temps de plancher », (fig.13. dans XII.8).
Les observations des modifications apportées lors de la maturation des farines sont principalement dues aux lipases qui permettent en enchaînement l’action oxydante des lipoxygénases natives du blé sur les protéines.
Dans les premières semaines après mouture cela apporte une augmentation des ponts disulfures (vue plus loin dans ce sous-chapitre), qui diminueront progressivement au-delà[185].
Après, (quelques mois quand même), c’est l’odeur et le goût de graisse rance, qui peuvent atteindre deux fois plus rapidement une farine complète qu’une farine blanche.
Pour cette raison, les recommandations de l’Asso. Nation. de Meunerie Française (Anmf) concernant la Durée Limite d’Utilisation Optimale (Dluo) est de neuf mois pour une farine « blanche », de type 55 et de type 65, et de quatre mois pour le type de farine intégrale – T 150 [186].
Au cours de la panification qui suivra, au pétrissage et dans la fermentation de la pâte, l’activité des lipases deviendra plus faible[187].
D’autres réactions enzymatiques liées aux lipides sont le plus souvent dues à l’apport supplémentaire des corps gras, soit par ajout de farine de légumineuses (fèves ou soja) plus riches en lipides et en lipoxygénases, soit par ajout de matières grasses pour stabiliser la structure de la mie des pains « toasts[188] » comme nous l’avons vu (XVI.4.4 et XVI.4.5 et les figures 1, 19 et 15).
Ce cas de figure d’addition ne sera pas trop observé ici, puisque l’objectif de ce sous-chapitre est de « lire » le positionnement naturel d’une farine. Mais comme les farines de légumineuses peuvent entrer dans le registre naturel et notamment dans la composition d’une farine de tradition, il est utile d’en dire un petit mot[189].
Dans le cas de figure de pétrissage intensif, l’« amélioration » que devrait apporter une farine de légumineuses ( fèves ou soja, contenant des lipoxygénases en grande quantité), s’est avérée ne pas être le choix le plus judicieux pour un aspect important, le goût. Puisqu’elles donnent de l’hexanal, un gaz qui dénature le goût, surtout quand le pétrissage est intensif [190](XVI.4.3).
Voilà pour les prémices de la dégradation enzymatique opérés par les lipases émanant de la petite portion lipidique de la farine de froment dans la pâte.
XVI.10.2. Les amylases natives
XVI.10.2.1. Les amylases natives dans les premières heures de la fermentation
S’ensuit, lors du pétrissage (température ajustée, ajout d’eau et malaxage) et de la fermentation (production d’alcool et d’acides organiques), une dégradation plus intense, c’est celle de deux grands composants nutritionnels de la farine, les glucides et protides.
 Les premiers éléments abordés par la dégradation enzymatique sont aussi ceux qui sont les plus accessibles lors de la germination, tant au niveau de leur situation dans la graine (en périphérie et près du germe), notamment la couche d’aleurone, qu’au niveau de leur faculté à être plus vite bio-assimilables (parce que contenant de plus grandes quantités de sucres simples[191]). Au lieu du 1 % des sucres simples contenus dans une farine « blanche », les « remoulages » issus de la périphérie du grain en contiennent jusqu’à 10 %, soit dix fois plus (figures 27 et 29). En ce qui concerne les protéines solubles, préférées aux protéines insolubles pour l’assimilation, les enveloppes du grain contiennent 30 % de protéines solubles du total des protéines. L’intérieur du grain ne contient que 15 % de protéines solubles, soit la moitié de leur présence en périphérie et du germe[192].
Les premiers éléments abordés par la dégradation enzymatique sont aussi ceux qui sont les plus accessibles lors de la germination, tant au niveau de leur situation dans la graine (en périphérie et près du germe), notamment la couche d’aleurone, qu’au niveau de leur faculté à être plus vite bio-assimilables (parce que contenant de plus grandes quantités de sucres simples[191]). Au lieu du 1 % des sucres simples contenus dans une farine « blanche », les « remoulages » issus de la périphérie du grain en contiennent jusqu’à 10 %, soit dix fois plus (figures 27 et 29). En ce qui concerne les protéines solubles, préférées aux protéines insolubles pour l’assimilation, les enveloppes du grain contiennent 30 % de protéines solubles du total des protéines. L’intérieur du grain ne contient que 15 % de protéines solubles, soit la moitié de leur présence en périphérie et du germe[192].
On le constate, tout est naturellement bien en place pour que la vie puissent bien se « starter ».
Après la partie germe, c’est le cœur du grain, l’albumen amylacé devenant farine blanche ou encore amidon et protéines, qui sera consommé, un peu comme une réserve d’aliment, pour continuer la voie de la germination de la graine donnant la plantule du blé (fig.8 dans XI).
Raymond Geoffroy[193] cite des travaux en 1926 de Pringsheim démontrant une augmentation de 30 % de l’amylolyse (dégradation de l’amidon), au bout de 6 heures avec l’adjonction de jus de levure bouilli. Ajoutons qu’au début du pétrissage, une production de maltose est multipliée par 47 avec 350 à 700 rotations de l’axe pétrisseur, suite probablement à la favorisation de renouvellement des contacts enzymes / substrat dans cet apport de brassage mécanique[194]. Encore faut-il que la levure en profite en assimilant ce glucose et surtout ce maltose, pour les espèces de levures « sauvages » ne sachant pas assimiler ce dernier (IV.9 et XV.4 et fig.30 dans ce chapitre XVI), information et notion qui est peu répercutée .
En malterie, Philippe Roussel[195] décrit la fabrication de la farine transformée en malt pendant trente heures, à ± 65 °C. Ce qui donne 58,55 % d’amidon, 9,32 % de dextrines, 4,35 % de maltose et 2,73 % de sucres indéterminés, à comparer avec les teneurs de la fig.24 dans VII.12.
Ici en boulangerie, les deux premières heures de fermentation panaire sont là pour consommer les 1 à 1,5 % de sucres « simples » (de une à deux molécules de glucose) présents. Après le pétrissage, avec l’apport d’eau et de ferments, la fermentation panaire, activée par ses microorganismes, a une dégradation nettement plus rapide que la germination. C’est un constat clair dans les premières heures de la fermentation.
Dans ces premiers temps d’ensemencement microbien de la pâte, ce seront les levures (avec en plus les bactéries pour le levain) qui consommeront les sucres directement fermentescibles (dits parfois sucres libres). Ces sucres simples sont composés de moins 0,1 % de fructose, moins de 0,1 % de glucose, 0,5 à 2,3 % de saccharose et 0,1 à 0,3 % de maltose et homologues supérieurs[196].
Ces sucres sont dits « simples », mais c’est comme souvent dans ce dossier, pour… simplifier, qu’on les appelle ainsi. Si l’on veut vraiment approfondir, il faut préciser que le sucre le plus simple est celui qui ne compte qu’une molécule – le plus souvent en panification, le glucose. Lorsqu’il est composé de deux molécules, il sera encore nécessaire de les scinder en deux molécules distinctes par les enzymes maltase et saccharase. Les enzymes vont là, séparer deux molécules liées entre elles.
Pour le sucre « simple » maltose, l’enzyme maltase va séparer les deux molécules de glucose accolées entre elles, pour procurer 2 molécules de glucose.
Rappelons qu’au niveau du goût, le maltose et le glucose ne sont pas repérés de manière identique comme nous l’avons vu (VIII.8), c’est important pour notre discernement gustatif.
Il est probablement assez essentiel de faire profiter la pâte d’une bonne transformation de l’amidon en maltose et autres sucres lors de la fermentation, dans une recherche de goût. Un repère professionnel pour les boulangers qui ont ce vécu, c’est le principe de conduire une pâte au levain sur plusieurs rafraîchis qui amène à introduire dans la pâte finale, une grande proportion de pâte ayant déjà subi diverses fermentations. Ainsi l’amidon est bien transformé et la dégradation a réalisé une « bonne transformation des sucres » (fig.24 dans XVII).
En résulte une saveur plus sucrée, voire « miellée », se rapprochant du goût « malté », quand l’acide produit ne couvre pas le tout (XVII.5.6).
Autre enzyme très tôt repérée, la saccharase. Comme souvent, c’est l’antériorité qui donnera au saccharose, une prévalence dans les différentes déterminations, ici des sucres. Par exemple, l’unité sucrante 1 (point de référence) est le pouvoir sucrant du saccharose. Tous les autres sucres, édulcorants intenses inclus, se référeront à cela. Le saccharose sera aussi appelé sucrose et l’enzyme portera indifféremment plusieurs dénominations, saccharase, sucrase et invertase.
Le saccharose n’étant présent naturellement que dans les sucres « simples » de la farine qu’en très petites quantités, l’enzyme le décomposant (la saccharase) ne sera importante que lors des premières heures et lors d’une panification avec ajout de sucres (généralement du saccharose, non observée dans ce sous-chapitre cernant les enzymes et ingrédients natifs du blé). L’enzyme saccharase va séparer les deux molécules soudées (une molécule de glucose accolée à une de fructose) pour procurer à l’assimilation ces deux molécules séparées.
Dans la fermentation de la pâte, la dégradation de ce di-saccharides se réalise dans l’espace entre les deux membranes de la paroi cellulaire[197] de la levure (fig.7 et fig.10 dans XV.5).
Il faut en plus savoir que tous ces « sucres simples » s’assimilent différemment, par tous les divers microorganismes du levain (voir fig.30 ci-après).
La fermentation panaire au levain naturel et à la levure va pouvoir disposer de ces diverses molécules de « sucres » (maltose, saccharose, fructose, glucose).
XVI.10.2.2. L’amylolyse et la consommation des divers microorganismes du levain
Si la diversité des « sucres » de la farine vous est peut-être mieux connue, sachez qu’il existe aussi une diversité de microorganismes dans la fermentation de la pâte au levain.
En effet, telle ou telle souche de levures ou de bactéries lactiques a des facultés d’assimiler le maltose, d’autres pas. Nous avons vu (XV.8.1), que dans la fermentation au levain naturel, il peut y avoir concurrence ou compétition entre microorganismes pour leur nourriture, pour les sucres disponibles dans la farine. Dans le meilleur des cas, une complémentarité s’installe mieux lorsqu’une levure fermente le glucose et la bactérie, le maltose, ce sont les sucres les plus présents dans la fermentation panaire.
Dans une fermentation ensemencée à la seule levure de panification, la situation est plus simple, d’autant que la souche « saccharomyces cerevisae » est une des rares souches de levure qui peut assimiler autant le glucose que le maltose. Ce qui n’est pas une propriété de toutes les espèces de levures « sauvages » présentes dans une fermentation ensemencée au levain naturel. En plus des Saccharomyces cerevisae, à notre connaissance, seule l’espèce de levure Candida tropicalis a été recensée dans les levains comme possédant également la faculté de dégrader (ou assimiler) le maltose en plus du glucose[198].
Dans le tableau suivant (fig.30) composé en refondant en un seul, ceux élaborés par G. Spicher pour les bactéries lactiques et les levures[199], vous pourrez remarquer les diverses aptitudes fermentaires sur les différents sucres de quelques microorganismes recensés au sein des levains naturels en Allemagne.
On y remarque que les autres levures du levain (à part la Saccharomyces Cerevisae), n’assimilent pas les sucres disaccharides, soit de deux molécules.
Les bactéries lactiques semblent mieux transférer le maltose en leur sein pour l’assimiler. Ce serait peut-être dû à une meilleure perméabilité de leur paroi cellulaire que la levure (XV.5 et XV.8)[200].
| Fig.30. Pour comprendre que les sucres simples
sont diversément assimilables ou non assimilables par les divers microorganismes présents dans la microflore du levain. Ce qui crée des compétitions entre eux ou au contraire une abstention de concurrence sur le substrat alimentaire glucidique. Surtout entre lactobacille et levure. |
|||||||||
| Genre et espèces
de microorganismes |
Monosaccharide | Dissacharide | Trisaccharide | ||||||
| Glucose | Galactose | Fructose | Maltose | Saccharose | Lactose | Melibiose | Raffinose | ||
| Bactéries lactiques homofermentaires strictes | |||||||||
| Lact.bac.Delbruekii | + | + | ± | ± | – | – | – | – | |
| Lact.bac.acidophilus | + | + | + | + | + | + | – | – | |
| Lact.bac.Leichmannii | + | – | + | + | + | – | – | – | |
| Bactéries lactiques hétérofermentaires facultatives | |||||||||
| Lact.bac.farciminis | + | + | + | + | + | – | – | – | |
| Lact.bac.plantarum | + | + | + | + | + | + | + | + | |
| Lact.bac.casei | + | + | + | + | + | – | – | – | |
| Bactéries lactiques hétérofermentaires strictes | |||||||||
| Lact.bac.brevis | + | + | + | + | – | – | + | ± | |
| Lact.bac.brevis ssp. Lindnerii I | + | – | + | + | – | – | – | ± | |
| Lact.bac. brevis ssp. Lindnerii II | + | – | – | + | – | – | – | – | |
| Lact.bac.buchneri | + | + | + | + | – | – | + | + | |
| Lact.bac.fermentum | + | + | + | + | + | + | + | + | |
| Lact.fructivorans | ± | – | + | + | + | – | – | – | |
| Levures acidotolérantes du levain | |||||||||
| Saccharomyces cerevisae | + | + | + | + | + | – | – | ± | |
| Pichia Satoi | – | – | + | – | – | – | – | – | |
| Candida krusei | – | – | + | – | – | – | – | – | |
| Torulopsis holmii | + | + | + | – | + | – | – | ± | |
| D’après SPICHER et STEPHAN, 1987. | |||||||||
XVI.10.2.3. La découpe de l’amidon par les amylases natives.
Voyons, après la consommation des sucres simples, la lente découpe de l’amidon.
Lorsque la consommation de ce petit pourcentage de sucres « simples » sera achevée, les besoins en sucres supplémentaires ne sauront être assumés qu’après découpage ou dégradation de ces longs bouts de chaînes d’amidon où les molécules de glucose sont accolées les unes aux autres.
Les microorganismes devront attendre que les enzymes végétales de la farine (pas ceux des microorganismes) cisaillent l’amidon, afin de procurer des mono-, di- ou tri-saccharides que les levures et bactéries lactiques pourront alors assimiler.
Michel Berger donne, au début des années 1980, une belle description de l’évolution de la consommation des sucres de la farine au cours de la fermentation. L’auteur signale « …la disparition rapide du saccharose et des hexoses [maltose, lactose, mélibiose] avant que ne puisse se constater réellement la métabolisation du maltose fourni par l’amylolyse. […] la quantité de maltose produit est donc le facteur limitant de la production de gaz carbonique… ». Le même auteur constate « deux zones de production de gaz […] la première correspond à l’utilisation des sucres préexistants directement fermentescibles et la seconde à celle du maltose produit. Entre les deux, on constate une diminution du débit de gaz carbonique correspondant à la période de transition ». « On doit cependant remarquer […] que la sélection des souches commercialisées (de levures) ne permet plus de visualiser aussi nettement ce phénomène ». C’est en effet l’époque où les levures à assimilation rapide du maltose (fig.11 de XV.6) arrivent sur le marché[201].
Dans ces années-là, l’objectif que l’on suivait concernant la fermentation panaire était d’aller toujours plus vite. À cette époque (les années soixante), la prise en compte de la fermentation comme un espace goût n’entrait pas en ligne de compte comme aujourd’hui par exemple[202]. Les boulangers d’alors observaient facilement, avant la génération des levures dites « à adaptation rapide au maltose[203] », une stagnation de la fermentation après une heure.
Celle-ci reprenait après un creux d’une ½ heure.
XVI.10.2.4. Le travail complémentaire des deux types d’amylases natives
Maintenant allons-y pour la carte d’identité des deux amylases « natives » de la farine.
Pour dégrader la « réserve » de sucres de l’amidon, le grain compte sur ces amylases natives du blé. Si on leur demande « leurs papiers » aux amylases natives du blé, on en a de deux types, l’αlpha amylase et la βêta amylase [204] (fig.31).
- L’alpha amylase (ou α-amylase) est dite endo-enzyme parce que son action de dégradation de l’amidon se déroule en plein milieu (à l’intérieur) de la chaîne d’amidon. Elle est aussi décrite comme métallodépendante au calcium (qui est plus présent dans la farine complète que dans la farine blanche – 2,5 fois plus.). Des auteurs signalent que l’ion calcium stabilise la structure de l’enzyme et agit comme activateur, mais le calcium peut aussi être inhibiteur de la βêta-amylase, c’est du moins ce qu’écrivent d’autres auteurs[205].
- La bêta amylase (ou β-amylase) justement, elle, est dite exo-enzyme, puisque son action de dégradation ne peut se réaliser qu’en démarrant d’une extrémité de la chaîne d’amidon et en dégradant par paire de molécules de glucose, soit maltose.
Cette distinction endo-enzyme/exo-enzyme est précieuse pour comprendre la complémentarité entre ces deux fonctions de dégradation enzymatique naturelle de l’amidon.
Cette dégradation provoque à l’extrême, une diminution de la viscosité (d’où l’action est dite parfois « liquéfiante » – XVI.9.1) et dans le cas de la dégradation de l’amylose donne en résultante, principalement du glucose, du maltose et du maltotriose[206].
Pendant que l’α-amylase coupe des bouts d’amidon, la β-amylase rend ses bouts d’amidon plus disponibles à l’assimilation en les réduisant en maltose (2 molécules de glucose soudées entre-elles), pour la levure de boulangerie et moins assimilables pour beaucoup de levures du levain, mais surtout disponibles pour les bactéries lactiques de ce même levain qui savent bien assimiler le maltose.
Apprécions l’importance de l’action conjointe des alpha et bêta-amylases.
Ce qu’il faut évaluer, c’est l’importance d’un équilibre entre l’action « dextrinisante », procurant des bouts d’amidon (dextrines), que procure l’α-amylase et l’action « saccharifiante », dégradation par paires de molécules de glucose (appelées maltose), que procure la β-amylase.
En effet l’aboutissement d’une action de la seule α-amylase donnera au sein d’une pâte, un aspect apuré et suintant que l’on retrouve lors de l’emploi de farine hyperdiastasique (IX.5), puisque la β-amylase n’évolue pas en teneur lors de la germination[207].
Voilà pourquoi cet équilibre est conséquent pour la qualité de la fermentation de la pâte[208].
Ce schéma d’action ne doit pas vous donner l’impression que c’est tout l’amidon qui est dégradé comme cela, mais seulement les petits bouts d’amylose et d’amylopectine à la périphérie du granule. Il est clair que le pain doit rester un apport de sucre complexes (amidon) et qu’il n’y a qu’une petite partie d’amidon qui sera dégradé en dextrines et sucres simples.
Lorsqu’on en arrive à avoir réussi à dégrader l’amidon et mis à disposition de nouveaux sucres « simples » assimilables, on revient vers la fermentation de ceux-ci déjà entrevue (VIII.8). Le « carburant » de la fermentation panaire est de nouveau disponible, et maintenant, on sort du système enzymatique végétal de la farine et entre dans le système enzymatique des microorganismes de la fermentation.
XVI.10.2.5. Les trois voies fermentaires du levain par les enzymes des microorganismes.
Le choix de notre approche de la fermentation-témoin étant celle du levain naturel, c’est une fermentation qui est biodiversifiée puisqu’elle a au moins trois voies fermentaires différentes (fig.25 dans XVI.9.2.1.1).
Chaque voie pourrait porter le nom de cascade enzymatique. L’enzyme en tête de cette cascade de dégradation, une fois sa mission réussie, va permettre à l’enzyme suivante d’œuvrer et ainsi de suite en démultipliant les actions.
Les trois voies fermentaires des deux types de microorganismes du levain empruntent parfois des bouts de chemins communs, comme, la transformation de la molécule de glucose en acide pyruvique, qui s’intitule la glycolyse. Nom qui vient du grec, et signifie scission ou dissolution du sucre.
Nous allons voir cela de manière récapitulative en donnant une version la plus épurée possible des appellations scientifiques.
Rappelons qu’à partir de la dégradation des sucres « simples », tout se passe à l’intérieur du microorganisme et que toute modification ou « amélioration » que l’on voudrait ou pas apporter est du domaine de la microbiologie, ce n’est plus dans la farine que peuvent s’aménager « des modifications améliorantes » . C’est clair qu’alors, on ne parle plus d’ajout d’enzymes végétales au sein du substrat farine, mais de choix d’amélioration ou modification de la souche de levures, généralement, ou de la souche de bactéries lactiques, c’est donc un choix des capacités enzymatiques microbiologiques et non plus végétales.
Le levain est une fermentation mixte, c’est-à-dire qu’il est à la fois une fermentation alcoolique et une fermentation lactique. D’accord, deux types de fermentation, mais pourquoi trois voies fermentaires. En fait, c’est la fermentation lactique qui se subdivise en deux voies différentes, déjà vues (VIII.8).
Voilà pour la transformation enzymatique des sucres hexoses et pentoses de la farine par les enzymes végétales et microbiennes.
XVI.10.3. Les protéases natives.
XVI.10.3.1. La dégradation, que l’on souhaite ménagée, des protéases natives.
 Ce vieux dessin de la dégradation enzymatique (fig.32) publié par les patrons boulangers suisses en 1949 montre bien que la dégradation des protéases est formatrice de goût dites substances aromatiques. La schématisation n’est pas à revoir, même si bon nombre d’appellations de l’époque ont changées. Diastases est à remplacer par amylases, sucre de malt par maltose, Peptones par peptides, trypsines par protéases, sucre de fruit par fructose, sucre de canne ou de betterave par saccharose. Albumine est à traduire par Protéines, Zymases à remplacer par un complexe de 12 enzymes de la fermentation alcoolique du glucose.
Ce vieux dessin de la dégradation enzymatique (fig.32) publié par les patrons boulangers suisses en 1949 montre bien que la dégradation des protéases est formatrice de goût dites substances aromatiques. La schématisation n’est pas à revoir, même si bon nombre d’appellations de l’époque ont changées. Diastases est à remplacer par amylases, sucre de malt par maltose, Peptones par peptides, trypsines par protéases, sucre de fruit par fructose, sucre de canne ou de betterave par saccharose. Albumine est à traduire par Protéines, Zymases à remplacer par un complexe de 12 enzymes de la fermentation alcoolique du glucose.
Venons-en à un autre registre, l’action de la protéase native du blé maintenant, on la craint plus, qu’une dégradation excessive de l’amidon, en disant que c’est parfois aller « un pont trop loin » dans la texture d’une pâte devant donner un pain bien alvéolé.
C’est cette déstructuration des protéines et notamment du gluten qui est redoutée. Surtout si on n’a pas envie de livrer le pain par en dessous de la porte ou dans la fente de la boite aux lettres. Une appréhension qui tourne à angoisse lorsqu’on en arrive à produire de la « savate » (mauvais travail), comme le décrit Émile Dufour[209]. On aboutit à cette autre appréciation des hommes de métier, lorsqu’on arrive à un état dit par Lionel Poilâne de « pourrissement » de la pâte, du à un excès de fermentation[210].
Tout est question de bonne conduite de la fermentation panaire qui doit s’adapter quotidiennement à des situations fluctuantes ; météo, changement de farine, par exemple.
Une vigilance et des réglages fins dans le suivi des paramètres, ajusté par l’expression professionnelle.
Cette dégradation de la pâte sera enclenchée et poursuivie d’autant plus rapidement si la récolte de l’année a subi une germination sur pied ou dans le cas plus rare, qu’elle a subi une introduction d’activité protéolytique du à des insectes (blés « punaisés »), par exemple[211] ou de moisissures.
La découpe des protéines en peptides et surtout acides aminés est un bénéfice nutritionnel, de par la meilleure pré-assimilation apportée. C’est ce qui résulte de la fragmentation des chaînes de protéines qui s’opère de toute façon en digestion, du moins si la taille moléculaire des protéines le permet (VII.7).
Certaines bactéries lactiques du levain apportent une dégradation des protéines et des peptides qui logiquement augmente la teneur en acides aminés, que démontre dans un tableau réalisé en 1983 par le microbiologiste allemand spécialiste du levain, Gottfried Spicher [212].
Mais technologiquement et comme dit d’entrée de jeu dans ce chapitre des protéases natives, le boulanger ne peut poursuivre une dégradation des chaines de molécules de protéines, d’amidon, de pentosanes poussées trop loin, jusqu’à déliter (désagréger) une pâte (fig.15 de ce chapitre et fig.21 dans XIX).
Même si nous avons découvert par ailleurs l’apport aromatique (VII.7) des dégradations des protéines du blé, souhaitons qu’elles soient « ménagées » et pas « poussées à l’extrême », gardons une structure pour donner une charpente à la mie.
XVI.10.3.2. Les différentes liaisons entre chaines protéiques.
Dès le début de ce chapitre sur les protéases natives de la farine, on dit que l’on ne parle pas que de la dégradation, mais aussi d’assemblage, pontage et liaisons entre les acides aminés des protéines.
En effet tout n’est pas que protéolyse (le chemin vers la dégradation). Il existe d’autres possibilités de transformations que la découpe en plus petits éléments des protéines. Et cela est intéressant technologiquement.
Sont possibles des réactions de pontage ou greffage entre chaines de protéines, en quelque sorte une liaison en réseau. Ce qui n’est que rarement le cas pour les « sucres » ou glucides de l’amidon de la farine.
La liaison peptidique (entre petites chaines d’acides aminés) se réalise entre le groupement acide (COOH) d’un acide aminé et le groupement amine (NH2) de l’autre. Au cours de la réaction, une molécule d’eau est éliminée. Il s’agit d’une action enzymatique qui condense, réticule.
Ce qui se vit dans le fournil notamment après un temps de pause (au pointage ou fermentation de la pâte après pétrissage) grâce à un geste plus artisanal qu’industriel, le rabat de la pâte. On y remarque de suite qu’après un simple re-pliage en portefeuille de la pâte sur elle-même on redonne une cohésion, un « corps », ou du « nerf » à la pâte, que celle-ci avait perdue lors d’un court temps de fermentation. C’était également un vécu des pâtes se pétrissant avec des temps de pause intermédiaires (XVIII.7).
Ce vécu, que l’on ressent facilement dans les mains, est une sensation perçue que les protéines sont des chaînes d’acides aminés promptes à rétablir des liaisons entre elles. Alors qu’avant ce rabat, dans la phase précédent ce « resserrement », la pâte était plus lâche.
En imagé, c’est comme si on enlevait les atomes d’hydrogène venu se fixer entre les deux atomes de soufre et l’on recréait le « pontage disulfuré ». C’est une image que j’aime beaucoup exprimer (fig.33).
Ce « resserrage » se réalise mieux après une légère levée de la pâte. Trop levé (ou trop d’écart), la pâte a difficile à se « relier », et c’est comme si le ressort ou l’élastique s’était cassé. Voyons les diverses possibilités de liaisons pour les protéines.
Dans les vingt acides aminés qui peuvent composer la protéine ou le peptide, il y a ceux qui aiment l’eau (les hydrophiles, on cite les acides aspartique et glutamique, l’arginine, l’histidine et la lysine[213]), ceux qui repoussent l’eau (les hydrophobes) et qui en se rassemblant entre eux, changent souvent l’ordre ou positions des acides aminés au sein de la chaîne de protéines.
Une recherche écrit[214] : « l’hydrolyse des protéines permet d’obtenir des peptides ou des protéines plus courtes qui peuvent être différentes après les coupures, car celles-ci sont souvent accompagnées de réarrangements (en phase aqueuse, à cause des propriétés hydrophobes) qui ont de nouvelles propriétés fonctionnelles, nutritionnelles et biologiques ».
D’autre part, dans ce même texte, on lit, « les prolamines riches en soufre (beaucoup de gliadines et les gluténines à faible poids moléculaire) ont une forte teneur en acide aminés hydrophobes », comme si ces liaisons d’acides aminés voudraient rester insolubles. On cite également[215] les acides aminés apolaires comme hydrophobes (alanine, glycine, valine, leucine, isoleucine, phénylalanine, cystine, proline et méthionine). Voilà des infos pour ceux qui veulent approfondir.
Pour les liens ioniques, les molécules (ici les acides aminés) peuvent être chargées d’ions, comme de l’électricité portée par un corps. La charge est soit négative (-) soit positive (+), on retrouve ici, les sigles décrits sur les batteries (fig.9 dans VII.7).
Il existe même sur le marché des appareils ioniseurs d’air ambiant apportant les ions négatifs pseudo-bienfaiteurs pour la santé. Ces appareils ont été accusés par certaines législations de publicité mensongère et parfois des accusations d’imposture médicale sont également recensées sur ces ventes d’appareils apportant, aux dires des concepteurs, un air aussi « tonifiant » que celle que l’on rencontre près des grandes chutes d’eau (par exemple les chutes du Niagara) qui brassent des masses importantes.
Y. Dacosta signale que le caractère cationique (soit : charge +) ou anionique (soit : charge -) varient fort suivant l’acidité du milieu. Peu ou pas d’analyses à ma connaissance ont été réalisées sur des pâtes au levain à pH différent d’une pâte levurée. De plus, comme le signale Yves Dacosta dans son ouvrage bibliographique sur le gluten en 1986, en ce qui concerne la fixation d’ions minéraux, si la pâte est salée et la farine complète plutôt que « raffinée », le milieu comporte plus de minéraux et modifie la charge globale[216].
Passons aux liaisons phénoliques (décrites aussi comme liaisons hydrogènes), présentes dans une farine, elles vont prendre de plus en plus d’importance avec l’approche d’ajout d’enzymes oxydantes dans une pâte de farine de froment. Ce sera en remplacement de ce qu’on demandait à des agents additifs oxydo – réducteurs (bromate – E 924 , XVI.4.7 et acide ascorbique – E 300, XVI.4.8).
Ces liaisons phénoliques sont des liens ou pontages assez puissants comme l’est le pontage disulfure qui suit.
Parmi les plus fortes liaisons, du moins les premières décrites par la science, et de ce fait, les mieux repérées par les études de technologie boulangère, ce sont celles qui s’établissent (après oxydation) entre deux atomes de soufre, appelées les ponts disulfurés.
C’est l’élimination d’un atome d’hydrogène attenant du bout de la molécule qui permet à deux atomes de soufre de se « souder ». Cette oxydation qui se réalise ici à la fermentation peut être accélérée par l’ajout d’agents ou des auxiliaires technologiques à pouvoir oxydant, par ex. : l’acide ascorbique (considéré comme un additif, E 300, XVI.4.8) ou une enzyme oxydante, type glucose-oxydase ou hexose-oxydase, mais non native dans la farine (XVI.11.3).
On le voit, avec les apports du mouvement de ce milieu aqueux qu’est la pâte, tout est en place pour se lier et se délier au niveau des chaînes (ou réseaux) protéiques.
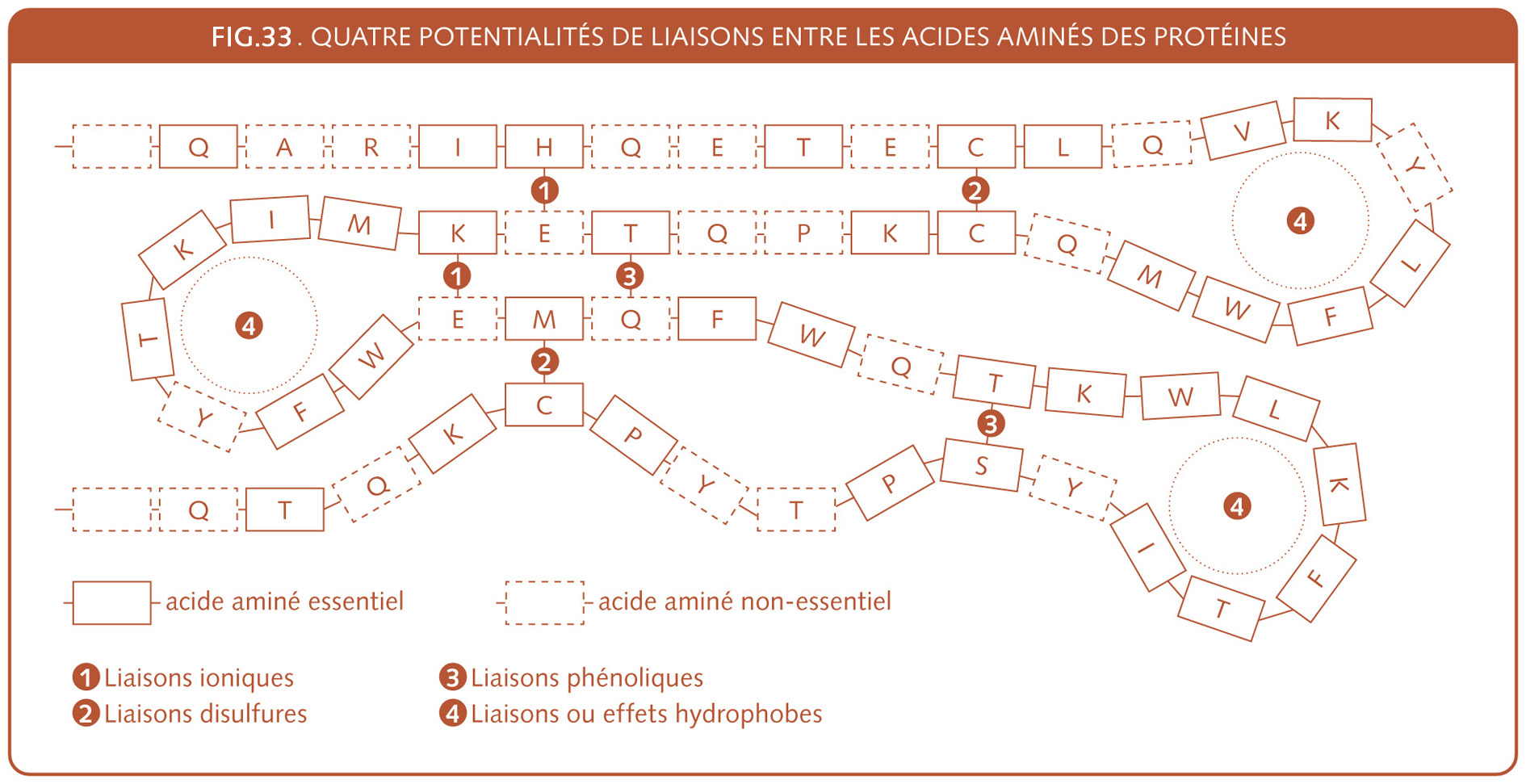
XVI.10.3.3. Le « pont trop loin » ou la dégradation trop poussée de protéases natives
Les levures sont un peu moins aptes que les bactéries à dégrader les protéines, elles secrètent cependant des protéases[217], surtout lors de leur lyse (auto-destruction en fin de vie). Une fermentation de la pâte ensemencée à la levure poussée trop loin en durée[218] arrive à être un milieu où des cellules de levures dépérissent. Ces levures mortes aux parois cellulaires désagrégées offrent alors leurs contenus à la pâte qui seront un apport nutritif de premier choix par tous les acides aminés essentiels, phospholipides, minéraux et vitamines qu’elle contient. C’est au point que le contenu des levures autolysées sont recommandables en supplément vitaminique dans l’alimentation humaine, après avoir subi une opération en plus[219]. Avant cette cytolyse (destruction de la cellule), certains peptides sont confinés au sein de la cellule de levure, citons un des plus repérés qui porte le nom de glutathion. Celui-ci, alors sans effet, puisque captif de la cellule auparavant, devient disponible dans la pâte lorsque la levure meurt et se désagrège.
Les ponts disulfures entre deux chaînes de protéines seront bien liées avant.
Et après l’action des levures désactivées et son glutathion elles vont se séparer et le ressort se casser, la pâte pourra ainsi se détendre.
L’apport des levures désactivées est présent dans le commerce[220] depuis le début des années 1990 (XVI.7), ce qui coïncide avec l’apparition plus fréquente des protéines à haut poids moléculaires.
Elles apportent un peu de détente, d’extensibilité, face à l’excès de ténacité à effet rétractable, pour des produits boulangers nécessitant des opérations d’abaisses ou d’allongement importants de pâtons.
Il peut exister une trop longue protéolyse dans les pâtes ensemencée au levain. Tout est question d’équilibre qu’un professionnel essaye de préserver. Mais sachez que les pâtes au levain ont un autre vécu que les pâtes levurées.
Dans un premier temps, parce que l’acidité du levain va régenter[221] différemment les accords, il peut y avoir entre les acides aminés et leurs ions des liens plus forts.
Gottfried Spicher consacre un chapitre à l’effet « régularisateur » de l’acidité du levain sur l’activité des enzymes. Au pH 4 – 4,5, les amylases du seigle sont « calmées » et les pentosanases « activées », dit-il. Deux cas de figure différents, mais tous les deux positifs pour la panification du seigle souvent très riches en amylases et comptant sur le côté absorbant des pentosanes.
Coté observation pratique sur froment, Raymond Calvel, en 1979, écrit[222] : « le levain facilite l’utilisation de farines faibles en gluten ». Plus analyste, Y. Dacosta, en 1986, parle de l’influence du pH (acidité ou mieux pouvoir d’Hydrogène) qui permet de mieux fixer les protons H+ et augmenterait les liaisons ioniques[223].
Dans la durée de la panification au levain, le « pont trop loin » existe aussi, bien évidemment. Si cela se maintient bien en terme de tenue de pâte au début grâce au frein apporté par l’acidification, un dépassement de la fermentation au levain et de la protéolyse donne des effets assez dévastateurs. La destruction rapide du réseau est l’accident à redouter puisqu’au bout d’un moment de cette longue fermentation, les bactéries du levain et l’acidité produites par celles-ci vont influer ensemble.
En effet, il existe deux grands types de protéases natives du blé. Un type actif en milieu acide (autour du pH 4), on cite l’aspartyl-protéase, et l’autre type active en milieu basique (entre les pH 7 et 9) que nous allons oublier ici, puisqu’en fermentation de farine de céréale, on se situe plutôt en zone acide.
B. Onno et P. Roussel écrivent[224] que « le pH optimum des enzymes protéases [aspartyl-protéases] est voisin de 4, l’acidification de la pâte favorise leur activation ».
Une fois arrivé, par le levain, au pH 4, on est à l’optimum du niveau d’activité des protéases du type acidophile de la farine. Si on est à ce point de pH 4, c’est que les bactéries ont travaillé pour en arriver là. Or ces bactéries lactiques faisant partie de la microflore du levain possèdent également des protéases. Voilà la deuxième attaque qui dégradent les protéines de la farine. Observons tout simplement par notre « lecture de pâte » que si le gluten est une protéine insoluble dans l’eau, il se dissout plus facilement avec l’acidité (IV.3). Voilà qui explique qu’une pâte au levain, lorsqu’elle se délite, le fait plus fort qu’une pâte ensemencée à la seule levure, qui a un pH moins acide et souvent une durée de fermentation plus courte.
XVI.10.3.4. Les diverses fonctions des acides aminés
Voyons maintenant les diverses fonctions des acides aminés.
Remémorons-nous le tableau des acides aminés avec leurs acronymes à une lettre en décrivant quelques fonctions qu’ils peuvent avoir (fig.9 dans VII.7).
Révélés sous un diagramme (dit de Venn), les acides aminés peuvent avoir plusieurs fonctions qui se dédoublent ou sont même triples. Mais ils ne sont pas en mesure de réaliser tous les rôles de liens hydrophobes, polaires, disulfures ou hydrogènes. La potentialité des fonctions des acides aminés est complexe et il n’est pas toujours évident d’en tirer une conclusion probante. D’autant qu’en s’associant entre eux, les acides aminés peuvent avoir d’autres expressions ou fonctions.
En résumé, ce n’est pas facile d’en tirer un enseignement, ce que l’on déjà pu remarquer à l’article concernant les aspects nutritionnels (VII.7).
On avance quelque peu et de manière plus précise dans le questionnement, mais on est loin d’apporter toutes les réponses aux multiples questions qui se posent et situations qui se présentent.
XVI.10.4. Les hémicellulases natives
Passons à un autre sous-chapitre des connaissances des enzymes natives de la farine et voyons maintenant la vie des hémicellulases sur les hémicelluloses dans la pâte, presque vécue comme un oubli technologique dans les manuels professionnels.
Une petite difficulté de compréhension est la terminologie puisque l’on retrouvera le terme « pentosane » employé indifféremment pour les versions solubles et insolubles des pentosanes, d’autant que les deuxièmes deviennent partiellement solubles au cours des transformations enzymatiques lors de la panification.
En France, on ne s’est pas beaucoup occupé des pentosanes ou hémicelluloses avant le début des années 1990 (IX.6). écrit en résumé, c’est parce que la donne était le pain blanc et que les pentosanes ou hémicelluloses se trouvent en quantités importantes à la périphérie du grain. Ce n’est pas seulement parce que les farines « blanches » en contiennent peu mais aussi parce qu’en plus le froment est la céréale qui en contient le moins, ce qui explique que leur approche technologique a été délaissée par les chercheurs en France et les autres pays de pain blanc de froment.
Il existe un rapport de teneur supérieur en pentosanes de 1,5 pour le seigle complet vis-à-vis du froment complet. Si on ajoute le pourcentage repris avant pour comparer seigle complet à du froment « blanc », on part dans un rapport de un (pour le froment « blanc ») à cinq pour le seigle complet. Voilà une explication partielle du désintérêt pour les pentosanes en pays de pain blanc de froment.
Toujours dans ces pays, on négligera d’approfondir technologiquement ce que les premiers traités de boulangerie française appelaient le « muqueux » du blé [225] (les hémicelluloses ou pentosanes), au profit quasi exclusif du « glutineux » du blé.
On a vu la technologie pour profiter des hémicellulases (IX.6) et voir comment s’expliquent le développement et la légèreté de l’amidon. Ici, on ne parle pas de légèreté du à l’alvéolage mais de l’expansion de l’amidon grâce à la disponibilité de l’eau dans une panification de céréales riches en hémicelluloses.
Voyons ce que l’on appelle les enzymes hémicellulases natives. Et c’est précieux puisque pour ce type d’enzymes, il y a beaucoup de discernement à avoir entre hémicellulases natives et hémicellulases ajoutées (XVI.11.2).
On signale [226] les hémicellulases du blé, principalement concentrées dans les parties périphériques du grain (la couche d’aleurone – fig.7 dans VII.6 et fig.1 dans XII.2) et elles sont dites en faibles quantités sur froment. Leurs activités varient suivant les variétés, et elles ont des niveaux d’actions encore une fois dits faibles par les chercheurs [227].
Pourquoi leur action est-elle minimalisée par ce qualificatif « …de faibles quantités » ?
Parce que tout simplement ces études les déclarent d’un niveau d’activité « très largement inférieure à ceux des doses d’hémicellulases utilisées en additifs [228] ».
Bizarre cette phrase ! Parce que l’on ne part plus de l’expression naturelle comme étant la référence, mais c’est l’addition qui est le repère. Là, on inverse la démarche, du moins celle que nous recherchions en repère dans ce sous-chapitre ci.
Encore une fois, pourquoi cette position de la recherche ? Peut-être, parce que l’on était déjà habitué au service rendu par ce « travesti » en amylases à effets secondaires (XVI.8). Peut-être aussi que la panification en évoluant a raccourci parfois à une partie de plus en plus congrue l’espace-temps de fermentation. Souvent en éliminant les pré-pâtes (levain, poolish) et en diminuant le pointage au profit de l’apprêt, dans la pâte. La farine n’ayant plus eu beaucoup de temps pour absorber l’eau, le rôle des pentosanes (capter l’eau) s’en retrouvera amenuisé.
Pour revenir au travesti d’amylases à effet secondaires, en effet, dès l’instant où l’amylase fongique [229] est apparue sur le marché (1979), des effets secondaires, qui venaient des hémicellulases, seront repérées et employées pendant presque vingt ans sous la dénomination « amylases à activités secondaires ». « Pour des raisons diverses, ces enzymes [hémicellulases] sont apparues en panification sous cette appellation. Très vite ces activités dites secondaires sont apparues comme principales », disent des spécialistes de l’hémicellulase[230].
Les hémicellulases ou pentosanases natives du blé auront la possibilité de couper à l’intérieur des chaînes d’arabinoxylanes[231] entre les molécules de xylose et en séparant les molécules d’arabinose attenant [232] à l’ossature de la chaîne de xylose (voir fig.12, du chapitre IX.6). Pour cette raison, elles sont souvent appelées endo-arabinoxylanes (XVI.1.2).
Ensuite l’action sur les pentosanes insolubles qui en deviennent solubles (10 % en fin de pétrissage et 25 % en fin de fermentation levure) est une des principales actions positives pour l’extensibilité de la pâte[233].
Moins de littérature existe sur les actions des pentosanases natives, bien que des écrits précédant l’arrivée des hémicellulases sur le marché décrivent l’interaction entre gluten et pentosanes-hémicelluloses. La pratique de longues fermentations observe une présence plus mousse et gommeuse, plutôt que ce ressenti un peu exclusif d’élasticité du gluten. C’est dans « l’effet mousse » que l’on soupçonne l’action des hémicellulases natives sur les hémicelluloses. Une synergie est même développée entre l’élasticité du gluten emprisonnant les bulles de gaz produite par la fermentation et le film d’hydrocolloïdes (la viscosité apportée par les pentosanes) qui tapissent les parois des alvéoles[234], cela renforce ainsi la structure des cavités gazeuses de la mie (XVII.8 et fig.2 dans XX.1).
Lorsque l’on dégrade les chaînes de hémicelluloses, les sucres pentoses « simples » (d’une molécule) seront « digérés » par les bactéries de la fermentation au levain par les bactéries lactiques pratiquant la voie hétérofermentaire[235].
XVI.10.5. Les cellulases natives
Pour les cellulases, elles existent vers les couches extérieures du grain ( fig.1 dans XII.2).
Les écrits sur la dégradation de la cellulose du blé en panification se développent un peu ces dernières années où l’on emploie souvent l’expression « dextranes » ou « glucanes » pour définir des sucres issus de la dégradation d’hémicelluloses ou celluloses[236]. Il peut être important de préciser que l’enzyme cellulase comme l’enzyme hémicellulase n’existent pas en digestion chez l’humain[237].
Cellulose et hémi-cellulose devraient préalablement passer par un trempage[238] ou mieux une fermentation pour transformer un peu d’aliments en nutriments, puisque cette dégradation semble bien demander plus de temps.
Encore une fois, l’empirique lecture de pâte nous met sous le regard attentif d’un professionnel.
Une uniformité de couleur de mie lors d’une longue fermentation au levain d’une farine intégrale est observée, tandis que dans une fermentation courte à la levure d’une même farine intégrale, le son (ou cellulose) viendra pigmenter la texture de mie. On y remarque une différence de dégradation flagrante. La cellulose comporte des matières intéressantes qui sont probablement un peu plus dégradées dans cette longue fermentation mixte (alcoolique et lactique) qu’est le levain, par rapport à une fermentation rapide à la levure.
On observe notamment ces autres hémicelluloses (hémi = à moitié en grec ancien), dont le plus repéré est le glucane qui se situe également à la périphérie du grain et spécialement pour l’avoine et l’orge. Il est composé, comme l’amidon, de molécules de glucose accolées l’une à l’autre, mais en plus grand nombre de chaînes et dont l’orientation des cellules est différente[239]. Peu d’écrits existent à notre connaissance, au point de ne pas pouvoir bien cerner le sujet.
L’objectif d’un traitement enzymatique des fibres alimentaires (cellulose du blé, ici) est d’une part, une augmentation des fibres plus solubles et d’autre part une amélioration des propriétés physiques et sensorielles des fibres[240]. On peut aussi penser aux mêmes effets que les pentosanes formant comme une gomme ou liant, appelé parfois gel.
XVI.10.6. Vue globale de l’action des enzymes natives.
Essayons de résumer dans une vue plus globale la transformation enzymatique du grain destiné à produire un épi de blé. Et comme souvent, faisons-le pour comprendre la vie de la pâte avec les forces venant du grain réduit en farine puis mélangé à l’eau.
Cette pâte subissant une lente action, assez proche de la germination, dans un premier temps, puis vivant un ensemencement de ferments qui active plus et donne plus de mouvements. On remarque que « lors de la germination, c’est du scutellum [sorte de coquille elliptique qui entoure la plantule du germe et la sépare de l’amande farineuse, fig. 2 dans VII.4 et fig.7 dans VII.6] que partiront les actions, qui par dégradation enzymatique, mettront l’amande farineuse à la disposition de la plantule[241] ».
Pour suivre les voies germinatives autant que fermentaires, la question est de savoir comment après avoir été bloquant, le phosphore fort présent dans le froment devient l’énergie qui permet de créer un processus de vie (VII.11).
Tentons un exemple en entrant dans l’intimité enzymatique d’une pâte. Allons voir comment cela se passe sur une toute petite parcelle de la transformation enzymatique qui se réalise dans la panification, celle qui va de la molécule de glucose à la molécule d’acide pyruvique (XVI.9.2.2 et XVI.10.2) lorsqu’on décrit les voies de dégradation du glucose.
Cette dégradation de la molécule de glucose est presque le « terminus » dans la fermentation de la pâte, elle requière dans la douzaine d’opérations enzymatiques, des transformations qui consomment de l’énergie et d’autres qui apportent de l’énergie (VII.11 et VIII.8).
Pour la première opération de dégradation du glucose, c’est l’atome de phosphore donné par une molécule qui en possède trois (l’Adénosine Tri Phosphate ou Atp) qui apporte l’énergie nécessaire et qui sera pour cette raison, appelé par les bio-chimistes, l’enzyme-clef de la glycolyse (c’est une hexokinase -VIII.8).
La première porte vers la dégradation s’ouvre. C’est donc le phosphore qui apporte l’énergie pour que celle-ci permette la dégradation de la molécule de glucose qui dans la germination aboutira à redonner une nouvelle plante et dans la fermentation de la pâte donnera gaz carbonique, alcool et acides organiques.
Il est également normal ou naturel que cette naissance de la nouvelle plante ou vie à partir du germe ne se déclenche que suivant des paramètres (acidité, humidité, température, ensoleillement) qui lui garantissent de pouvoir continuer au mieux son but.
Ce sont des aspects que l’on perçoit dans la problématique de l’acide phytique liant et bloquant l’assimilation des minéraux dans un premier temps puis les rendant disponibles grâce à la dégradation due à l’enzyme phytase. Les minéraux réalisant là une barrière à franchir dite « pouvoir tampon » par les scientifiques (VII.11).
G. Spicher consacre dans son livre un sous-chapitre à cet effet tampon des matières minérales de la farine dans le levain[242]. Au point d’utiliser la phytine comme régulateur voir stabilisateur de l’acidité, un peu comme l’emploi du sel en fermentation panaire. Un ajout de phytate (0,1 à 1 gr.) est jugée approprié lors de la méthode de conduite du levain en continu (procédé industriel). Chez le même auteur, on lit[243] : « Par leur faculté d’effet-tampon, les phytates contribuent dans la solution à ce que le pH du levain reste assez longtemps dans un secteur optimal pour la phytase ( pH optimum : 5,0 à 5,5 ) ».
En somme c’est comme si cela était, dans les voies fermentaires, une étape à franchir après l’autre pour en faire le parcours, il faut gravir un escalier après l’autre pour passer aux prochains étages.
Ces étapes qui une fois apportent l’énergie nécessaire à la dégradation de la molécule de glucose et une fois réalisent une transformation qui prend de l’énergie.
Elles vont prendre deux atomes de phosphore (l’énergie) dans la première partie de la glycolyse et les rendre en double dans la deuxième partie, puisque la molécule sera divisée en deux au milieu de cette glycolyse.
Après c’est parti pour vivre cela en boucle, pour d’autres transformations d’autres molécules de glucose, d’autant que les enzymes reste disponible après leurs actions.
Les douze enzymes composant le complexe de la zymase opérant dans la glycolyse, auront grâce à l’apport de molécules de phosphore dédoublées, une action perpétuelle et pourront continuer leurs fonctions de germination, de fermentation et de bio-assimilation des nutriments.
C’est réglé comme un mouvement de mécanique perpétuel et naturel, qui, en plus, stocke et augmente de l’énergie. Il faut l’observer avec respect comme un mouvement qui nous guide.
Ne bougeons rien, tout est bien en place.
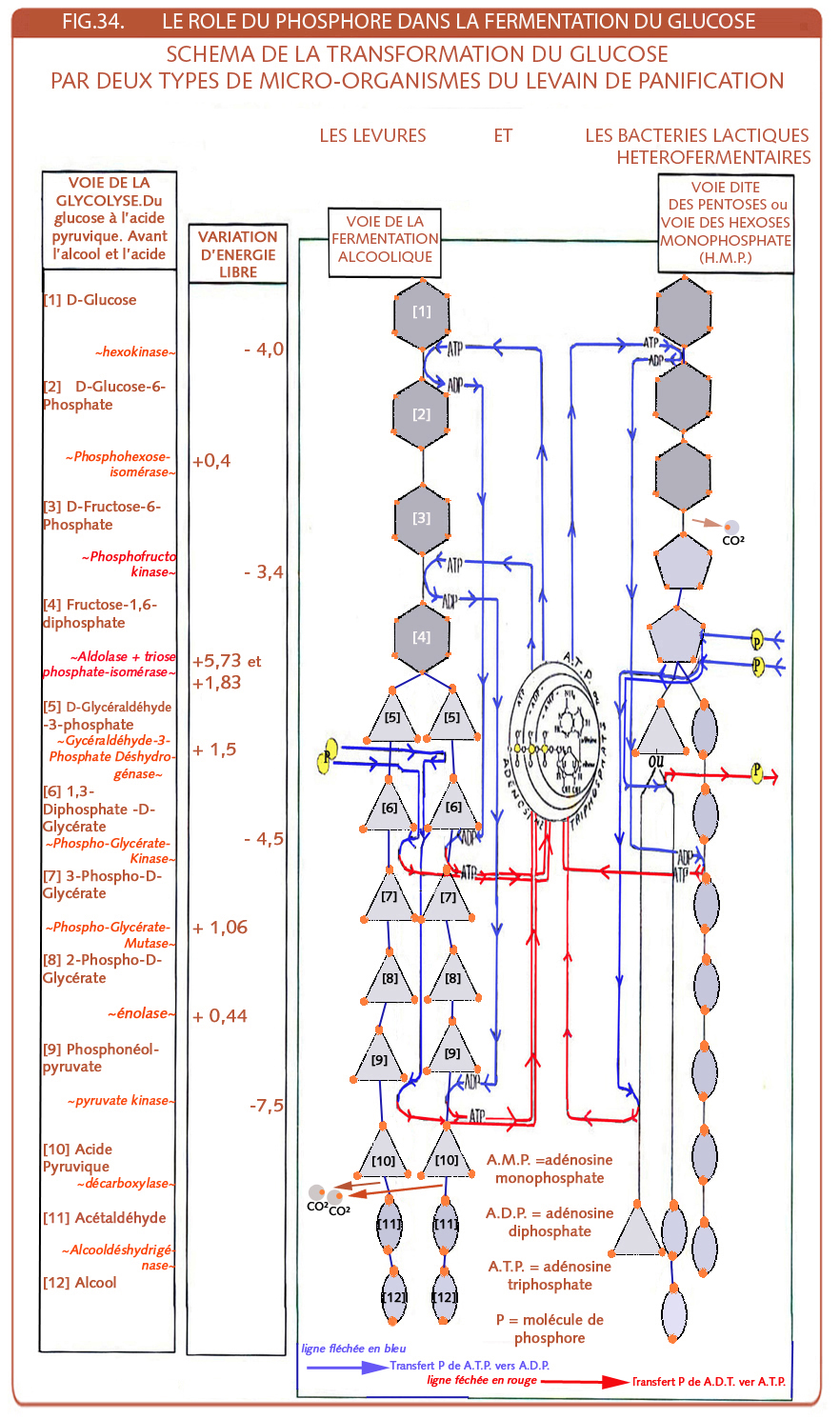
XVI.11. L’ingénierie enzymatique et ses propositions
« L’enzyme est un outil naturel pour améliorer les produits de boulangerie. L’action des enzymes a été citée aussi longtemps que le pain a été cuit au four. Les anciens attribuaient la fermentation à une force de vie magique, mais aujourd’hui nous la comprenons, comme un résultat de la manière dont les enzymes modifient les ingrédients. Vous êtes-vous déjà demandé ce qui fait le pain élastique, résiliant où comment il se fait que des pains ont la capacité de rester frais plus longtemps ? Eh bien, les enzymes sont la réponse. Les enzymes ont des applications dans tout le processus de panification, y compris l’amélioration de la farine, l’amélioration du volume, la texture et la couleur, prolongeant la douceur et l’élasticité de la mie, et assurant de plus longue durée du pain frais ».
La source de ces propos, une communication d’une firme d’enzymes qui dans son logo se veut de repenser l’avenir[244]. C’est presqu’à l’identique ce que disent les fabricants des matières premières pour boulangerie-pâtisserie dans leur « livre blanc » (XVI.2) un demi siècle avant. Une des dernières communications de cette firme concernant la boulangerie nous dit : « Quand une miche de pain perd de la fraicheur, le pain devient dur. Gardez cette douceur en ajoutant des enzymes à la farine pour modifier la structure de l’amidon. Pour les boulangers pressés, les enzymes peuvent également rendre la pâte moins collante. D’autres enzymes de boulangerie spécialisées aident à retenir les gaz naturellement présents dans le gluten. C’est ainsi que les boulangers peuvent préparer du pain léger et moelleux[245] ». On continue le texte sur l’incidence des enzymes boulangères venant de la firme aux dimensions internationales, qui est une des plus importantes productrices d’enzymes. « Dans un environnement économique difficile, où la fluctuation des prix des matières premières presse les boulangers contre les exigences des consommateurs en matière de qualité, les enzymes sont de plus en plus considérés comme une solution naturelle et innovante pour les entreprises de boulangerie d’aujourd’hui. Ceci parce que leur mode d’action est unique et permet non seulement de réduire les coûts de production mais aussi augmente les bénéfices et améliore la durabilité[246] ».
Ah ça ! tapez Freshness bread, soit maintien de la fraicheur dans le pain, sur un moteur de recherche et vous vous verrez proposer par toutes les firmes productrices d’enzymes, une solution pour garder votre pain frais.
XVI.11.1. Les amylases exogènes
XVI.111.1.Des amylases exogènes pour une dégradation accélérée de l’amidon
Avant de parler d’accélérer, peut-être voulez-vous plus de discernement, peut-être voulez-vous savoir si l’apport d’enzymes est correctif ou additif ?
Il est temps de voir comment a évolué la proposition commerciale d’autant qu’elle est introduite dans le sac de farine et que l’on ne sait pas l’extraire que ce soit en tamisant ou d’une autre façon. En technologie de la pâte à pain, les firmes para-boulangères, (à vocations facilitatrices) ont toujours voulu augmenter la dégradation des glucides pour alimenter les levures formatrices d’alvéoles de gaz et retarder la dégradation des protides pour maintenir la structure emprisonnant le gaz carbonique.
Dès que l’on a pu réaliser ces deux effets de manière séparées et contrôlées on s’y appliquera.
Pour aller chercher un esprit critique, on reprend ce granule d’amidon schématisé (fig.20 et fig.21 dans XVI.9.1) afin de comprendre ce qu’est l’ingénierie enzymatique qui se retrouve dans notre sac de farine.
Le granule de farine est composé de deux types d’amidon.
Il est nécessaire de comprendre ces différences puisque dans l’amylose, les molécules de glucoses sont liées par l’atome carbone 1 de la molécule qui précède, à l’atome carbone 4 de la molécule de glucose qui suit (liaisons dites 1,4).
Dans le cas de l’amylopectine, un amidon qui contient un pouvoir plus gélifiant que l’amylose (d’où son suffixe pectine), là où il existe un branchement, la liaison s’effectue toujours à partir du carbone 1, mais c’est au carbone 6 de la molécule que se fera la liaison au départ de la ramification.
Mais revenons sur notre granule d’amidon (fig.21).
Il est dégradé par une amylase, mais il n’existe pas une seule sorte d’amylase.
Nous avons vu (XVI.10), que dans les amylases natives du blé, il y a déjà deux sortes, l’alpha-amylase et la bêta-amylase qui sont complémentaires dans leurs actions.
L’alpha-amylase du blé peut dégrader la chaîne de molécules de glucose en coupant n’importe où. Sauf qu’elle ne sait pas dégrader (couper) les endroits où il y a des branchements. Techniquement, ce n’est pas de son ressort (fig.20 dans ce chapitre).
Avec les amylases natives du blé, le noyau du granule d’amidon reste presque intact avec ce qu’on appelle des « dextrines limites ». Ici, on a l’expression comme la démarcation des possibilités de dégradation des enzymes natives.
En apport externe, l’α-amylase fongique est venue sur le marché dans les années 1950 en Allemagne et plus de quinze ans après en France.
Le second type d’enzymes amylases natives ; la bêta-amylase ne sait couper les chaînes de molécules de glucose qu’à partir du bout et en scindant par groupe de deux molécules de glucose à la fois ( soit maltose ). Mais de nouveau, elle arrêtera son action de dégradation à l’approche des départs de ramifications, là aussi, ce n’est plus son domaine.
En voulant aller plus vite dans la dégradation enzymatique, pour nourrir les levures, on s’est dit qu’on va ajouter une enzyme amylase, qui elle, sait débrancher et couper ces liaisons carbone 1 / carbone 6 (dites 1,6), et qui contrairement au malt, ne comporte pas de protéases dégradant le gluten.
C’est là qu’intervient la pullulanase qui doit son nom à la dégradation des pullulanes. Le pullulane est le nom donné à un sucre composé de trois molécules de glucose (soit maltotriose), lié entre elles par l’atome carbone 1 et l’atome carbone 4. Au bout du maltotriose pour réaliser d’autres liaisons, il n’existe que la possibilité d’une liaison entre les atomes carbone 1 et 6. Et on a trouvé une pullulanase produite par le bacille acidopulluliticus qui réalisait cette dégradation du lien1,6.
La pullulanase fut autorisée en France en 1993 et on lui attribue parfois les qualités de préservation du moelleux grâce à ce « débranchage » de l’amylopectine, mais elle n’est pas thermorésistante. Comme auxiliaire technologique, elle débranche les ramifications, ce qui donne un granule d’amidon dégradé comme vu dans la fig.5 dans VIII.8 et la fig.20 dans XVI.9.
Pour « améliorer » la rapidité de la dégradation de l’amidon, on peut aussi aller prendre l’enzyme amyloglucosidase produite par une moisissure (l’Aspergillus niger). L’amyloglucosidase fut autorisée en France en 2001 et elle est capable de couper tous les types de liaisons, celles qui lient les carbones 1 et 4 comme celles qui lient les carbones 1 et 6 (fig.20 dans XVI.9).
L’ « amélioration amylasique» de la panification n’a prioritairement ici que l’objectif d’empressement. Et la compétitivité de certains enzymes fait que certaines ne répondent pas toujours aux attentes des formulateurs, du moins ceux qui préfèrent rencontrer une vitesse d’exécution.
Maintenant que l’on voit qu’une amylase n’est pas l’autre et que finalement l’ingénierie enzymatique peut nous préparer n’importe quel type de frappe quasi chirurgicale, il faut encore différencier ces alpha-amylase, pullulanase et glucoamylase entre elles.
Suivant qu’elles proviennent de microorganismes différents, elles peuvent avoir des dispositions différentes également suivant ce que va vivre le milieu pâteux, ce sera vrai surtout pour les alpha-amylases.
Les producteurs d’amylases auront de quoi se différencier par leurs produits commerciaux, d’autant que ce n’est pas au poids de poudre enzymatique que se mesure l’activité des enzymes mais au katal (unité d’activité catalytique) suivant des équations scientifiques assez complexes[247].
Il faut savoir que la même enzyme, mais de fabricants différents auront des activités différentes à poids égal. Ce sera une des difficultés des meuniers qui se veulent formulateurs.
On a déjà vu des doses trop importantes d’hémicellulases liquéfier trop les pâtes des boulangers utilisateurs. Des surdoses de lipases émulsifiant des apports exogènes de matières grasses procurer des goûts de fromage à des pâtes enrichies au bon beurre. Des pâtes se cintrer par excès de gluco-oxydases. La maitrise de l’ajout enzymatique qui bénéficiera d’un bon étiquetage, et non d’occultation sera mieux assumée. La formulation enzymatique devrait être réalisée par un consultation entre les meuniers et leurs clients. Malheureusement le débat est bien loin d’être si instruit que pour pouvoir être ouvert.
Les températures et le niveau d’acidité déterminent des zones d’activités différentes (XVI.9.1), et là aussi il existe des choix au point que le cocktail enzymatique risque d’être différent d’un formulateur à l’autre.
On voit ici l’importance des formulateurs du cocktail d’enzymes, plus importants en termes d’interventions techniques que le fabricant d’enzymes.
Le « formulateur » n’est pas forcément un fabricant d’enzymes. Il peut acheter ceux-ci chez le fabricant et composer les coktails en fonction de l’état de la récolte ou des demandes spécifiques des clients.
XVI.11.1.2. Des amylases exogènes thermorésistantes freinant le rassissement
Même si on remarque aisément que l’ajout de tel ou tel type d’amylases change la donne, on n’a pas fini de parler des différentes amylases que normalement vous devriez discerner technologiquement. La dernière à être arrivée sur le marché est l’amylase dite bactérienne parfois dénommée en plus, malto-génique (c.à.d. ; générant du maltose), agissant sur la conservation du moelleux qui est citée plus haut dans les propos d’une firme de fabricant d’enzymes (XVI.11).
Ce qui va nous permettre de comprendre son action est l’expérience de Boussingault en 1852.
| fig.35. Pour comprendre que le rassissement du pain n’est pas le séchage du pain.
Voici les mesures de Jean-Baptiste BOUSSINGAULT réalisées du samedi 12 au vendredi 18 juin 1852 |
|||||
| Dates | Heures | T° du pain | T° de la pièce ou est entreposé le pain | Poids
et pertes de poids du pain |
|
| Samedi 12-06-1852 | 9 h. | 97°C | 19°C | 3, 760 kgs | |
| ¨ | 10 h. | 81°C | 19,1°C | ||
| ¨ | 11 h. | 68°C | 19°C | ||
| ¨ | 12 h. | 58,1°C | 19,1°C | ||
| ¨ | 13 h. | 50,2°C | 19°C | ||
| ¨ | 14 h. | 44°C | 19°C | 3,735 kgs | |
| ¨ | 15 h. | 38,6°C | 18,9°C | – 25g / 5h. | |
| ¨ | 16 h. | 34,7°C | 19°C | Soit 0,66% | |
| ¨ | 17 h. | 31,6°C | 18,7°C | ||
| ¨ | 18 h. | 28,9°C | 18,6°C | ||
| ¨ | 20 h. | 25°C | 18,4°C | ||
| ¨ | 22 h. | 23°C | 18,3°C | 3,730 Kgs | |
| Dimanche 13-06-1852 | 7 h. | 18,8°C | 18,1°C | ||
| ¨ | 9 h. | 18,3 °C | 18,1°C | ||
| ¨ | 10 h. | 18,1°C | 18,1°C | ||
| ¨ | 11 h. | 18°C | 18°C | ||
| ¨ | 12 h. | 18°C | 17,8°C | ||
| ¨ | 14 h. | 18°C | 18°C | ||
| ¨ | 19 h. | 17,8°C | 17,7°C | ||
| Lundi 14-06-1852 | 9 h. | 17°C | 17,4°C | 3,727 Kgs | |
| Mardi 15-06-1852 | 9 h. | 16,1°C | 16,5°C | 3,712 Kgs | |
| Mercredi 16-06-1852 | 9 h. | 15,8°C | 16,3°C | 3,700 Kgs | |
| Jeudi 17-06-1852 | 9 h. | 15,8°C | 16,3°C | 3,696 Kgs | |
| Vendredi 18-06-1852 | 9 h. | 15,8°C | 16,3°C | 3,690 Kgs | |
| – 70g sur 84 h, soit – 1,86% | |||||
| D’après BOUTROUX, 1897. | |||||
Jean-Baptiste Boussingault lance des « expériences ayant pour but de déterminer la cause de la transformation du pain tendre en pain rassis ». Car pour lui, « ce changement d’état suit l’abaissement de la température, et il ne m’a jamais paru qu’il fût raisonnable de l’attribuer à un effet de dessiccation ». Son expérience consiste à évaluer la perte en eau du pain pendant le rassissement.
Après six jours, la perte de poids du pain n’était que de 40 gr. par rapport à un poids de départ de 3.730 gr., soit une perte d’un tout peu petit plus que 1 %.
Au bout des quatre pages relatant ses expériences dans les annales de chimie et de physique, sa conclusion est « que ce n’est pas par la moindre proportion d’eau que le pain rassis diffère du pain tendre, mais par un état moléculaire particulier qui se manifeste pendant le refroidissement, se développe ensuite et persiste aussi longtemps que la température ne dépasse pas une certaine limite ».
Cette expérience probablement que tout consammat(trice)eur l’a vécu en « repassant » des pains au grille-pain ou au four.
Alors quel est cet « état moléculaire particulier » auquel Jean-Baptiste Boussingault fait allusion ? On l’appelle aujourd’hui la rétrogradation de l’amidon ! êtes-vous plus avancé avec cette définition ? Une figure (fig 1 du chapitre XXII .2) vous permet d’avoir un schéma pour aider à la compréhension.
C’est bien tout ça, mais au début de ce sous-chapitre, on écrit que l’on recherche à comprendre les propositions de l’ingénierie enzymatique ? Or ici avec l’amylase bactérienne, l’astuce pour la recherche d’enzymes exogènes est de repérer dans toutes les amylases qui existent, celles qui résistent à la cuisson.
L’idée est alors d’en maîtriser la fonction de dégradation après la cuisson. On la doit en terme de proposition commerciale à la firme d’origine danoise, Novozymes en 1991.
Dans la revue Filière Gourmande de mars 2002, on donne les commentaires de Christine Rosa, ingénieure chez Novozymes France. Celle-ci dit : « En effet, sans risque de surdosage et sans interférer ni sur la consistance des pâtes, ni sur la structure de la mie ou le volume des produits, Novamyl [nom du produit commercial de l’amylase bactérienne thermo-résistante] opère directement sur le moelleux des produits de boulangerie dès Jour + 1 en retardant la rétrogradation de l’amidon tout au long de la conservation[248] ». L’action se déroule après cuisson[249]. Propos que des firmes ne réitéreront pas, peut-être pour éviter le déclassement du statut d’auxiliaire technologique à cette enzyme.
Avant cela dans la littérature technologique française, l’amylase bactérienne était évitée justement pour ces raisons de thermo-résistance[250] interférant après la cuisson.
On connaissait déjà en boulangerie des problèmes de résistance à la cuisson par la maladie du pain filant dit « ropy » en anglais, c’est-à-dire visqueux vu l’état du pain qui, malgré qu’il était cuit, redevenait flasque (XIX.5).
C’est le bacille dit populairement « des foins » (apparaissant souvent à l’époque caniculaire de la fenaison) qui est responsable de cette maladie du pain filant, il est dit thermorésistant. On l’appelle aujourd’hui bacille subtilis (autrefois bacille mensentericus) et son enzyme amylase est encore fort active à 70 à 80 °C.
Mais un autre bacille est encore plus performant va être découvert, c’est le bacille appelé licheniformis puisqu’il aurait (vu au microscope) la forme un peu « fleurie » de lichens. Là, c’est à 90 à 95 °C que se trouve la température optimale de cette amylase, elle sait encore mieux résister à la cuisson à l’intérieur du pain. Difficile de dire que l’on ne recherche pas la thermo-résistance et pourtant certains disent que si l’amylase bactérienne se retrouve après cuisson, c’est que le boulanger a mal cuit son pain. Argumentation un peu facile qui veut surtout se dédouaner, d’autant que l’on sait de notoriété scientifique, que la température de la mie ne dépassera jamais les 95°C, tant qu’il restera de l’eau dans celle-ci, ce qui est le cas.
Une fois le pain cuit, ces amylases bactériennes peuvent être toujours actives sur l’amidon en diminuant l’enchevêtrement du réseau recristallisé (dense) de l’amidon, en coupant des branchements ou en sectionnant à partir des extrémités des ramifications d’amidon, deux molécules de glucose (maltose) par deux molécules de glucose, action dite maltogénique pour l’amylase du bacille stearothermophilus.
Ces actions seront « limitées aux zones cristallines séparées »[251] par d’autres alpha-amylases (des dextrines, déjà coupées de l’arborescence des chaînes d’amyloses- Voir fig.4 dans VII.5, fig.20, fig.21 et fig.24 dans XVI.9). D’où la mention de non-interférence sur le volume et la texture employée par l’ingénieure de la firme novatrice, vu quelques notes plus haut dans ce chapitre.
Les amylases thermorésistantes réalisent leurs actions en utilisant aussi les propriétés « d’agents dépresseurs d’Aw » [252]. C’est à dire, qu’il faut suffisamment d’eau pour l’activité enzymatique, aie lieu (XVI.9.1.2), et comme on est dans un produit cuit, et de plus sujet à dessiccation, les conditions d’inactivation des enzymes seront de plus en plus remplies. Néanmoins ces actions permettront à la mie de pain cuite ainsi traitée, de garder plus longtemps son moelleux. L’utilisation de ce type d’enzymes devra se réaliser avec précaution dans un but bien particulier[253] pour ne pas prolonger la formation de dextrines (morceaux d’amidon) pendant la cuisson.
Malgré l’ingéniosité technique de cette nouvelle enzyme exogène, deux problèmes cependant ;
- Premièrement, la classification de l’enzyme dans les auxiliaires technologiques ne répond plus à la définition de ceux-ci par la législation européenne.
Lisons attentivement la directive CE ; « On entend par [auxiliaire technologique] toute substance non consommée comme ingrédient alimentaire en soi et volontairement utilisée dans la transformation des matières premières, des denrées alimentaires ou de leurs ingrédients, pour répondre à un certain objectif technologique pendant le traitement ou la transformation et pouvant avoir pour résultat la présence non intentionnelle de résidus techniquement inévitables de cette substance ou de ses dérivés dans le produit fini et à condition que ces résidus ne présentent pas de risque sanitaire et n’aient pas d’effets technologiques sur le produit fini[254]. »
- Deuxièmement, le risque sanitaire d’allergie ou d’intolérance risque de prendre un certain temps avant de pouvoir être décelé si il a lieu de l’être.
Il faudrait afin d’évaluer le risque d’innocuité, que le produit de cuisson en contenant fasse mention de sa présence, ce qui n’est malheureusement pas le cas, lorsque l’on déclare l’enzyme de amylase, sans plus de précision.
Manifestement, il y a matière à débat.
XVI.11.2. Les hémicellulases exogènes
Passons maintenant aux ajouts d’hémicellulases, pentosanases où xylanases
Revoilà ces mots « pentosanases » ou « hémicellulases » dont on n’avait jamais beaucoup parlé, il y a trente ans d’ici. Aujourd’hui, c’est à peine si les cours théoriques de boulangerie en parlent.
Et pourtant, actuellement on les retrouve sur les étiquettes de nos sacs de farine.
On a vu (XVI.10), que ces hémicellulases sont peu natives dans la farine de froment, mais que c’est depuis leur introduction dans les complexes enzymatiques ou améliorants que le secteur des adjuvants y prête attention. Une des difficultés pour la compréhension, ce sont les différents noms employés en dénomination. Déjà, pour le substrat dégradé (les sucres pentoses), il existe une confusion[255].
De nombreuses variétés d’enzymes hémicellulases existent sur le marché.
Il faut attribuer cette plus grande diversité à la plus grande complexité de ces chaînes de sucres pentoses par rapport aux chaînes d’hexoses (glucose) qu’est l’amidon.
« Le terme d’hémicellulase désigne une famille d’enzymes dont les membres sont capables de décomposer les pentosanes. Leur impact sur la panification et les propriétés de la pâte varie toutefois beaucoup d’une enzyme [hémicellulase] à l’autre [256] ».
Plusieurs firmes productrices d’enzymes ont d’ailleurs une gamme importante d’hémicellulases[257], ce qui démontre un peu cette multiplicité d’actions potentielles.
Notamment les fabricants d’enzymes allemands (Röhm et Mühlenchemie) ont su préserver leurs primautés dans les initiatives en matière de production d’hémicellulases. La première (aujourd’hui devenue AB Enzymes puis AB Maury), qui a été précurseur de ce domaine des pentosanases, présente une quinzaine de xylanases en mélange ou pas avec des amylases fongiques et des xylanases transglutaminases, c’est-à-dire une xylanase qui permet de lier les pentosanes avec les protéines.
Des xylanases bactériennes ciblent parfois les hémicelluloses insolubles avec un bulletin final couché sur prospectus commercial, d’apport d’extensibilité, régulation et volume.
La deuxième firme allemande (Mühlenchemie) présente une douzaine de propositions avec également des mélanges amylases et hémicellulases et cible pratiquement les mêmes effets.
Des spécificités pour la panification du seigle ou pour de longues fermentations sont également rencontrées dans leur offre.
L’action des xylanases (la troisième dénomination) se différencie, comme les amylases, natives avec l’impossibilité ou pas de dégrader aux approches de branchements ou ramifications[258].
Il existe, comme pour les protéases, non seulement la potentialité des dégradations en de toujours plus petites portions, mais aussi des possibilités de connexion en de plus longues assemblages, liaisons intra-éléments ( entre chaînes pentosanes ) et parfois inter-éléments ( entre chaînes pentosanes et chaînes de protéines ), vu plus loin.
Pour profiter technologiquement des hémicellulases, il importe, comme toujours, de ne pas trop dégrader les chaînes de celles-ci. L’on a remarqué par exemple que les coupes des endo-xylanases (séparation opérée à l’intérieur de la chaîne de xylose) se réalisaient plus difficilement à l’endroit où les sucres pentoses arabinose se trouvaient en lien ou jonction sur le chapelet des sucres pentose xylose (fig.12 dans IX.6). Ce qui procure des plus longs bouts de chaînes de xylose, intéressants technologiquement par leur plus grande faculté de capter l’eau ou de réaliser une meilleure viscosité. C’est pour cette raison que ce sont les endo-xylanases qui entreront de manière préférentielle dans le choix d’hémicellulases en panification, puisqu’elles permettent de garder de plus grandes chaînes d’arabinoxylanes contrairement à une dégradation opérée par des exo-xylanases qui coupent à partir des extrémités deux molécules de xylose par deux molécules de xylose, à l’image des bêta-amylases (XVI.10.2).
Par contre, à l’inverse, si l’on veut rendre cette chaîne de pentosanes plus facilement dégradable en petites portions, une action spécifique séparant la molécule d’arabinose de la chaîne de xylose rendra celle-ci plus apte à réaliser cette action de découpe avec l’ajout de l’enzyme arabinofuranosidase.
Autre particularité d’action sur les pentosanes, comme il existe des pentosanes insolubles, il est préférable de rendre celles-ci solubles plutôt que dégrader les pentosanes solubles.
« Il ne semble pas qu’une différence importante de composition existe entre les formes solubles et insolubles. Le poids moléculaire et le degré de ramification interne de la molécule expliqueraient la différence de solubilité[259] ».
Dernière action, les pontages entre chaînes de pentosanes ou entre chaînes de protéines et chaînes de pentosanes se réalisent grâce à des enzymes estérases sur les acides férulique ou coumarique attachés à la molécule d’arabinose elle-même attenante à la chaîne de molécules de xylose. C’est encore une opération d’oxydation accélérée aux dépens de l’oxydation positive qu’apporte la fermentation.
Ces deux acides sont parfois regroupés sous le nom générique d’acide cinnamique avec l’acide sinapique, ils se retrouvent principalement dans la fraction insoluble des pentosanes, à 88 % pour la farine, à 81 % pour la pâte. L’acide férulique est majoritaire (entre 84 à 86 %), l’acide coumarique est minoritaire (2 %) et diminue au cours du pétrissage. L’acide sinapique est à 4 % des acides cinnamiques et sa teneur augmente à 9 % dans les pâtes[260].
Cette action de maturation accélérée ne se réalise que grâce à l’oxydation de ces acides cinnamiques. Ce qui sera en quelque sorte « forcé » par l’ajout volontaire d’enzymes oxydases permettant d’effectuer plus rapidement ce travail de ponts hydrogènes dits aussi phénoliques.
Voyons les liaisons entre pentosanes.
Une fois l’acide férulique estérifié (oxydé), il va pouvoir se lier à un autre acide férulique, l’acide se dénommera alors, acide diférulique. Ce qui donnera lieu à ce pontage entre deux chaînes de pentosanes.
Le tout permet de réaliser, à cru, un effet mousse gélifié que l’on peut schématiser comme suit pour une compréhension simplifiée ou l’on voit apparaître en éclats les acides féruliques prêt à se réunir par l’oxydation.
Ces acides devenus diférulique par leurs jonctions créent comme un gel pâteux (fig.12 dans IX et fig.22 dans XVI).
Autre liaison qui peut se réaliser entre chaîne de protéines et chaînes de pentosanes. Cette une liaison dite hydrogène ou phénoliques entre un atome d’hydrogène et un atome d’oxygène (XVI.10.3). Deux acides aminés semblent les plus sollicités dans ces liaisons[261], il s’agit de la tyrosine et de la cystéine. La deuxième étant déjà sollicitée pour les ponts disulfurés.
Ces liaisons se passent entre l’acide férulique de la chaîne des pentosanes et les acides aminés de la chaîne de protéines. On a voulu expliquer cette formation de gel à cru en schématisant sur une succession de deux figures (fig.36).

XVI.11.3. Les oxydases exogènes
XVI.11.3.1.La maturité de la pâte accélérée par ajout enzymatique oxydant.
Essayons pour finir, d’aborder l’apport des enzymes oxydantes exogènes.
Voyons ce que l’on pourrait appeler (pour l’humour du jeu de mot) l’effet « de Serres ».
En 1600, lorsque Olivier de Serres parle de qualité du grain et de la farine, il fait, comme beaucoup à cette époque, une différence entre farine issue du blé battu de l’épi, soit battu depuis longtemps ou battu depuis peu. Il préfère les seconds, à servir pour les maîtres, tandis que les premiers seront servi aux servant(e)s – dixit.
En quelque sorte, il évite une oxydation, en préférant une farine issue de grain qui n’a pas trop de « plancher » (XII.8). Mais bien sûr, cette citation tient plus de l’observation à une époque où la science commence à peine à se structurer. Il écrit aussi plus loin qu’« une farine se conservera longtemps (plus de 7 à 8 mois), si on la moud dans le décroissant de la lune [262] ». Comme il répètera [263] une croyance populaire sans vraiment bien l’expliquer : « le blé mal cultivé se transforme en ivraie ».
Plus actuel et pour ressentir ce thème des oxydases au fournil, il nous suffit à nous boulange(re)s d’observer la différence entre une pâte morte (dite aussi verte) et une pâte à maturité. Cette dernière a plus de corps, plus d’aération, de vie en somme.
Ce qui donne à une pâte « l’âge mûr » c’est une oxydation qui peut parfois se dénommer maturation ou « prise de force ». C’est principalement au pointage que s’opère ce passage « de la jeunesse à l’âge adulte ».
Le pointage, cette fermentation de la pâte en masse, a été de plus en plus négligée dans nos fournils. C’est pourquoi dans une volonté de solution afin de panifier « vite et bien », le professeur Calvel avait préconisé un ajout de pâte pré-fermentée (XVII.1.5) apportant plus rapidement cette maturité à la pâte qui en bénéficie. « Il faut faire avant ce qui est difficile de faire après », écrira le professeur Calvel[264]. Dans les processus industriels, le pointage a été carrément abandonné lorsqu’il s’agit de faire vivre à la pâte crue ensemmencée à la levure, la congélation.
Vite ! Speed ! Fast ! Une obsession aiguisée en boulangerie aussi bien sur. De tout temps, on a voulu aller plus vite. Et sous toutes les latitudes de la vie, l’obtention de la maturité a toujours été un empressement difficile à gérer. En plus, au niveau commercial, soumettre la maturité de la pâte à l’exercice de rentabilité économique va inévitablement faire l’objet de recherche de « raccourcis ».
Pour l’oxydation en meunerie et boulangerie, cela ira de traitement avec des gaz oxydants la pâte à l’ajout d’additifs oxydo-réducteurs en passant autrefois par des traitements à l’arc électrique, (XVI.4.7), jusqu’aux enzymes glucides-oxydants, dont on discoure ici.
De toutes ces formes d’acquisition rapide de la maturité de la pâte, ne retenons ici que le prédécesseur autorisé et le plus utilisé en France sont les quelques dizaines de milligrammes d’acide ascorbique ajouté au kilo de farine. Nous avons déjà vu (XVI.4.8), que c’est le décret dit « de tradition française » en 1993 qui exclura l’acide ascorbique de sa sphère légal. Cela va, en quelque sorte, promouvoir l’enzyme glucose-oxydase et le passage de l’additif à l’auxiliaire technologique dans ce domaine de l’oxydation des autres farines que celles de tradition.
| Fig .37. L’additif et son code européen remplacé depuis les années 1990
par l’auxiliaire technologique qu’est l’enzyme, qui ne doit pas être déclarés dans les produits cuits |
||
| Au revoir l’additif | Bonjour l’auxiliaire | Effets recherchés |
|

Lipase |
Émulsifiant pour mixer matières grasses et pâte |
| Protéase,
Levure désactivée |
Assouplissant de ténacité | |
|
Gluco-oxydase | Oxydant permettant renfort par liaisons |
Amylase |
Dégradation ménagée pour activer la fermentation | |
Hémicellulase |
Suivant l’hémicellulase Dégradant ou au contraire
occasionnant pontage |
|
| Transglutaminase | Liant
Occasionnant pontage |
|
| Amylase thermorésistante | Conservant la fraîcheur | |
| Simple lecture de l’évolution dans le monde des producteurs de matières premières pour boulangerie en France. | ||
La teneur native d’acide ascorbique ou vitamine C est minime dans la farine. Par conséquence, les teneurs natives des enzymes acide ascorbique oxydase et acide ascorbique déshydrogénase le sont aussi. Si ce détail est important, c’est simplement pour signaler que ce soit additif ou auxiliaire technologique, les réactions d’oxydo-réduction enclenchées sont enzymatiques quelle que soit l’origine de la « catégorie légale » de l’agent engendrant l’oxydation (additif ou auxiliaire technologique).
Dans l’objectif fixé, de permettre un discernement professionnel des boulanger(e)s, il sera utile de mesurer le potentiel d’oxydo-réduction d’une pâte et d’évaluer les diverses interventions proposées aujourd’hui par l’ingénierie enzymatique.
XVI.11.3.2. L’oxygène, le cinquième ingrédient des pâtes ?
Il existe en France un laboratoire au Conservatoire des Arts et Métiers (Cnam) où une équipe s’attelle à cette tâche de la mesure du potentiel d’oxydation de la pâte. Depuis pas mal d’années, on fait des recherches au point d’avoir créé de toutes pièces deux instruments de mesure spécifiques. En 1993, est construit le pétrin bioréacteur, en 2003 ce sera le sitoxygraphe qui sera élaboré avec les connaissances accumulées au cours des dix années précédentes.
Une brève présentation des deux outils s’impose si l’on veut comparer les mises en situation opérées scientifiquement avec les méthodes qui seront rencontrées au fournil.
Le pétrin bioréacteur du Cnam (1993). Dans une cuve où les paramètres (T°) sont contrôlés, le petit fraseur va opérer 1.200 rotations par minutes, dans une pâte hydratée à 70%.
L’instrument permet d’analyser les gaz et la consommation d’oxygène.
Le sitoxygraphe du Cnam (2003). C’est un pétrin à axe horizontal qui pétrit la pâte hydratée à 60 % avec ± 1 200 rotations par minutes. Un sas permet les retraits sans trop d’interférences d’oxydation externe. L’analyse porte sur les gaz également. Cet outil a été réalisé par Michel Loiselet grâce au soutien des groupes Soufflet et Puratos. Deux caractéristiques du diagramme opéré pour les tests se rencontrent plus en procédé de pétrissage industriel qu’artisanal. Les 1 200 rotations (encore que l’on peut les relativiser), et les pétrins fermés par un couvercle.
En plus signalons que dans l’évolution de la boulangerie artisanale, un désengagement vis-à-vis du travail intensif au pétrissage pour se réinvestir vers des temps de fermentation plus long a été la tendance ces derniers temps.
Afin de repartir de la base, en 1767, dans un des premiers manuels de boulangerie française, on trouve ces expressions : « Pour bien composer la pâte et pour faire du bon pain, il faut que la pâte soit suffisamment travaillée et par les levains et par les bras ». D’ailleurs, « lorsque l’on emploie moins de levain, il faut plus de travail et on est obligé d’y employer plus de levain lorsqu’on la [la pâte] travaille moins », relate Malouin [265]. à la page suivante, celui-ci signale encore qu’« à Paris, on fait dépendre la bonté du pain, plus des levains que du travail ». Encore plus loin dans l’écrit, « le travail du levain dans la pâte surpasse encore celui des mains ». On est vraiment dans le siècle des lumières avec ces écrits.
Depuis, tout comme au Conservatoire des Arts et Métiers (Cnam) créé un peu plus tard, en 1794, que les écrits dont nous faisons mention, beaucoup d’eau a coulé sous les ponts de la Seine. Les conditions de travail ont changé, le pétrissage n’est presque plus manuel et le levain après être tombé en désuétude ne reprend de la pratique que depuis deux à trois décennies. Comme les changements opérés en panification iront renforcer le pétrissage et diminuer les temps de fermentation. Dans cette phase du pétrissage, on monte de 300 tours à 1 200 tours/ minute du bras fraseur et en fermentation, on descend de 6 h 30 min, jusqu’à 1 h (XVIII.6 et fig.18 dans XVIII.7)
Il n’en est pas moins vrai que le pétrissage et la fermentation sont deux opérations qui oxydent la pâte, plus on insiste sur une des deux, moins il faut mettre d’accent sur l’autre. Nous l’approfondirons plus loin (XVIII.3.).
Dans la balance pétrissage / fermentation, c’est le pétrissage qui a occupé toujours plus l’espace par rapport au positionnement décrit dans les premiers manuels.
Un point qui s’observe aussi plus dans l’artisanat que dans l’industrie, c’est quand il faut choisir, on préfère marier les deux éléments (farine / eau), plus par capillarité en longue fermentation qu’en les fouettant longtemps ensemble.
Comme l’espace fermentation est l’endroit où se forme le goût, ainsi que beaucoup de meilleures bio-assimilation et épuration dans le cas de la panification au levain que nous approfondirons encore (XVIII.7), favoriser l’option de la fermentation sur le pétrissage semble bien « couler de source ».
« L’oxygène ! un ingrédient des pâtes » : l’équipe du Cnam sort en 2010 un article sous ce titre, reprenant le parcours de 17 années d’expériences conduites avec les deux pétrins instrumentés vus plus haut. D’emblée on y précise l’incorporation d’un oxydant, simplement, l’oxygène de l’air. « Pétrir c’est oxyder ». Le titre de l’article est donc « L’oxygène, un ingrédient oublié de la pâte », il détermine bien ce que les études veulent cerner. « L’oxygène est intéressant avec […] son caractère oxydant, renouvelable et gratuit », « on peut même considérer l’oxygène comme le 5ème ingrédient de la pâte après la farine, l’eau, la levure et le sel [266]. »
Que se passe-t-il avec l’oxygène dans la pâte ? Qu’oxyde-t-il ?
Une recherche[267] va jusqu’à donner 60 % de la consommation d’oxygène par les acides gras, pourtant peu nombreux dans la pâte de blé tendre, mais tellement aisément hydrolysables (par les lipases), puis en enchaînement, oxydables (XVI.10.1).
Le glucose oxydé par la levure (qui respire et fermente) prend 10 % de la consommation d’oxygène[268]. Nous arrivons à un total d’oxydation expliquée de 70 %. Le restant, les 30 % d’oxygène consommés ne sont pas encore interprétés, bien que quelques pistes soient à confirmer[269]. On sait notamment que l’ajout d’enzymes, de glucides-oxydases, nécessaire aux ponts phénoliques créés par les estérases de l’acide férulique augmente la consommation de ± 4 %. L’ajout de farine de légumineuses riche en lipoxygénase ou d’autres enzymes lipases hydrolysant les acides gras favorisera aussi la consommation d’oxygène. Si l’on ajoute des agents oxydants du type farine de fève et son enzyme lipoxygénase ou l’enzyme exogène, glucose-oxydase, on augmente évidemment la consommation d’oxygène.
On remarque toutefois que la principale voie de la consommation d’oxygène est l’oxydation des acides gras par l’enzyme lipoxygénase endogène (ou native).
La lipoxygénase est une des premières enzymes oxydases décrites (XVII.10.1).
Lorsque Roger Drapron décrit cette action de la lipoxygénase dans la pâte, en 1974[270], il en dépeint plutôt les aspects négatifs. Ce n’est pas tellement l’enzyme lipoxygénase native qu’il met en cause [271]. Il incrimine les lipoxygénases de fève et de soja qui oxydent les acides gras polyinsaturés libres et ceux portés par les triglycérides, tandis que l’enzyme lipoxygénase native ne dégrade que les acides gras polyinsaturés libres. Ainsi l’ajout de la farine de fève risque d’apporter en excès l’oxydation puisque 100 fois plus efficiente (XVI.4.3). Celle-ci couplée à « l’augmentation de l’intensité du pétrissage, généralisée depuis une vingtaine d’année [fin des années 1950] modifie considérablement l’importance de l’effet de la lipoxygènase [272] ». Signalons pour restituer le contexte des années 1950-1970, qu’à l’époque l’on voulait sortir d’une période de « pain noir », (la guerre 40-45 et la nécessaire reconstruction de l’économie qui suit) et que vers les années 1970, les publicités des produits de lessive avaient inventé une « nouvelle » couleur, « le plus blanc que blanc », cet esprit va « déteindre » jusque sur le pain.
Le professeur Raymond Calvel emboitera le pas et dans la campagne contre l’ajout de farine de fèves, il qualifiera l’action dévastatrice de « lessivage [273] », terme bien repris dans les fournils. De l’éditorial « Avoir raison … malgré tout » de mai 1981 à un autre éditorial de la même revue en décembre 1986, « Des idées qui font leur chemin », le professeur Calvel apprenait que dans certains moulins importants, les farines avec ajout de farine de fève ne représentaient plus que 30 à 40 % des ventes. Ce qu’il considère comme un acquit positif.
Suite à ces dénonciations et rimant trop avec vent, l’adjuvant farine de fèves va progressivement régresser voire disparaître en panification française.
Autre récente évolution, mais plutôt chez les anglo-saxons, le retour vers la farine « unbleachead », soit farine « non blanchie » par des gaz oxydants, sera vue comme positif, au niveau du marché d’outre-Atlantique.
Voilà, en une bonne dizaine de pages, une tentative d’explication de l’ajout enzymatique et les propositions commerciales qui en découlent. Je pense que ces passages permettent d’un peu plus en savoir et de sortir d’un thème souvent assez difficile à comprendre et à expliquer.
Mais je dois avouer qu’après la publication du document de travail sur les enzymes en 2012, souvent des confrères m’ont demandé une « documentalase », si pas une aspirine.
| fig.38. Trente ans d’autorisations d’enzymes en France,
pour la panification des pains courants et spéciaux |
|||
| Nom de l’enzyme | Microorganismes producteurs | Dates d’ autorisation | Utilisé en boulangerie pour… |
| α Amylase | Aspergillus niger | 1989 | Les seules autorisées pour le pain de tradition française. Fournit les microorganismes en sucres. |
| α Amylase | Aspergillus orizae | 1989 | |
| Amyloglucosidase | Aspergillus niger | 1989 | Fournit les microorganismes plus rapidement en sucres simples assimilables. Améliore la couleur |
| Pullulanase | Bacillus acidopullulyticus | 1993 | Débranche l’amylopectine pour pouvoir nourrir plus rapidement les microorganismes. |
| Amylase maltogène | Bacillus subtilis | 1993 | Enzymes thermorésistantes pour dégrader l’amidon afin de nourrir plus rapidement les microorganismes de la fermentation.
Utilisent leurs thermorésistances pour dégrader l’amidon gélifié puis recristallisé après cuisson. |
| Amylase maltogène | Bacillus subtilis (recombiné*) | 1994 | |
| Amylase maltogène | Bacillus licheniformis | 1994 | |
| Hémicellulase | Aspergillus Niger | 1994 | Agissent sur la rétention d’eau pour une meilleure gélification de l’amidon. Améliore texture et volume |
| Endoglucanase / Pentosanase | Humicola insolens | 1994 | |
| Glucose-oxydase | Aspergillus niger | 1997 | Permet une maturation/oxydation accélérée, ce qui organise plus vite les liaisons pour créer le maillage du réseau glutineux. |
| Hémicellulase | Bacillus subtilis (auto-clôné**) | 1998 | Enzyme plus thermorésistante qui agit
pour une bonne rétention d’eau comme les pentosanases |
| Cellulase | Trichoderma longibrachiatum | 1998 | Agit pour meilleure rétention d’eau afin d’améliorer la gélification de l’amidon |
| Endoxylanase | Aspergillus niger (recombiné*) | 1999 | Certaines augmentent la capacité d’adsorption d’eau afin d’améliorer la gélification de l’amidon
D’autres xylanases peuvent diminuer la ténacité de la pâte en dégradant les chaines de pentosanes . |
| Xylanase | Aspergillus niger (recombiné*) | 1999 | |
| α Amylase | Microbacterium imperiale | 2001 | Permet de fournir plus vite les microorganismes de la fermentation en sucres simples. |
| Amyloglucosidase/Glucoamylase | Aspergillus niger | 2001 | Débranche l’amylopectine. |
| Arabinofuranosidase | Aspergillus niger | Entre 2001 et 2016,
Souvent après la directive C.E. de 2008 |
Permet de mieux débrancher les chaines de pentoses |
| Hexose oxydase | Hansenula polymorpha | Encore un action accélératrice de l’oxydation des pâtes et une des plus polyvalente sur les substrats | |
| Lipase | Aspergillus oryzea (recombiné*) | Effet émulsifiant pour les lipides de la pâte endo- et exo-gènes, d’où amélioration de la texture pour les pâtes riches en matières grasses. | |
| Lipase | Rhizopus orizea | ||
| Phospholipase | Aspergillus niger (recombiné*) | Même effet émulsifiant des lipides, plus propre aux lipides endogènes de la farine. | |
| Protéase | Aspergillus niger | Détente d’un réseau glutineux trop tenace | |
| Transglutaminase | Streptoverticillium mobaraense | Surnom : colle à viande. Permet des liaisons entre les divers réseaux (protéiques comme glucidiques). | |
| Xylanase | Aspergillus niger (recombiné*) | Augmente la capacité d’adsorption d’eau, afin d’améliorer la gélification de l’amidon.
Risque d’apparition de collant en surdose. |
|
| Amylase maltogène | Bacillus licheniformis (recombiné*) | 2016 | Dégrade l’amidon gélifié puis recristallisé pour sauvegarder un effet de fraîcheur de mie.
Par sa teneur résiduel du à sa forte thermorésistance, elle autorise un travail post-cuisson. |
| Glucose oxydase | Aspergillus niger (recombiné*) | 2016 | Autorise une maturation/oxydation accélérée, créer vite des liaisons entre les chaines de gluten, par ex. |
| Phosphodiestérase
(aussi issu de levure autolysée) |
Leptographium procerum | 2016 | Donne un effet relaxant à la pâte trop tenace.
Vendu également, sous forme de levure désactivée. |
| Xylanase | Aspergillus acidus (recombiné*) | 2016 | Augmente la capacité d’adsorption d’eau afin d’améliorer la gélification de l’amidon. |
| La libre circulation des enzymes officialisée par directive C.E. en 2008, autorise d’autres offres d’enzymes commerciales.
* recombinée = produit par des microorganismes génétiquement modifiés. ** auto-clôné = même procédé que recombinée, mais limitée en dénomination à ce qui pourrait se produire naturellement. |
|||
| D’après POTUS et NICOLAS, 2009-2010, BESANCON, 1997, POTUS et aL, 1996, LOUARME, 2004 et arrêté du 04-01-2016. | |||
XVI.12. La démocratie versus lobby et la nouvelle génération d’enzymes
Essayons de comprendre comment se prennent les décisions au niveau du cadre législatif qui nous implique tous, inévitablement. Pour cela, voyons l’interprétation de l’ Amfep ( Association of Manufacturers and Formulators of Enzyme Products ) sur les « statuts » à accorder à l’enzyme. Au point 1, l’Amfep doit se positionner début des années 2000 par rapport au projet initial de la Commission Européenne (C.E.) qui entreprend d’harmoniser les législations des pays membres. Et lorsque la C.E. classe comme additif l’enzyme qui est fonctionnelle dans le produit alimentaire final parce le substrat est présent et que le pH et la température sont appropriés, l’Amfep prend la position de le classer comme ingrédient alimentaire. Ce qui sera peut-être accepté par la C.E., puisque l’on sait pas si la directive est définitivement opérationnelle, vu que la procédure d’harmonisation ne semble pas aboutie, pour ne pas dire freinée.
Nous aurons l’occasion de revenir sur cet aspect d’enzyme « fonctionnelle » dans le produit final, c’est-à-dire viable au sein de la denrée alimentaire consommée. Ce n’est pas anormal dès le moment où l’enzyme est native, ce que laisse supposer que les termes ; « substrat présent avec pH et température appropriées ». Mais est-ce vraiment le cas des propositions enzymatiques faites au secteur de la boulangerie ?
Il existe une certaine rétention d’information de la part des fournisseurs, signalée jusque dans un éditorial de la revue Industries des Céréales[274]. Cette rétention d’information est clairement exprimée, voire souhaitée par un autre lobbying, la Fedima (la fédération des fabricants et fournisseurs d’ingrédients de boulangerie).
Ce lobby écrit en décembre 2006 que « la proposition [de la CE] ne favorise pas la propriété intellectuelle et l’innovation de nos produits ». Le communiqué de la Fedima poursuit en signalant « … que les conditions de l’utilisation seront basées sur l’utilisation sûre des enzymes. » Est-ce parce que l’on souhaite « une lecture amicale » et ne pas contribuer à « l’hésitation du consommateur pour les additifs » que « comme les enzymes utilisées dans nos produits ne sont pas en activité dans le produit de consommation final, il n’y a aucun besoin de les déclarer » ?
En conclusion pour la Fedima « marquer la catégorie « enzymes » serait un bon compromis. » Tous les textes entre parenthèses qui précèdent sont extraits des « Premiers commentaires sur la proposition concernant les agents d’amélioration d’aliments ». Si on écoute ce conseil, notre sac de farine ne préciserait pas quelle famille et type d’enzyme sont ajoutés.
D’un côté, la CE ne l’a pas écouté tout à fait, puisque cette proposition ne sera pas suivie par la Commission qui sortira en décembre 2008 son règlement 1333 sur les additifs, enzymes et arômes (voir article 3 paragraphe 2 b).
Aujourd’hui, c’est sur l’obligation de précisions de la classe de « grande famille » enzymatique que l’on retrouve sur l’inscription obligatoire où chaque enzyme reçoit une autorisation avec un numéro de nomenclature qui se trouve sur le site de l’université de Braunschweig ou plus officieusement, de l’Iub (Union Internationale de Biochimie[275]).
Et d’un autre côté, on l’a écouté ce conseil des lobbys des producteurs et formulateurs d’enzymes, pour une bonne part en tout cas, puisque l’article 12 du chapitre 1 de la directive 1331/2008 précise : « Parmi les informations fournies par les demandeurs, le traitement confidentiel peut être accordé à l’information dont la divulgation pourrait nuire sensiblement à sa position concurrentielle. Les informations relatives à celui-ci ne doivent pas, en toutes circonstances, être considérées comme confidentielles : (a) le nom et l’adresse du demandeur ; (b) le nom et une description claire de la substance ; (c) la justification de l’utilisation de la substance dans ou sur des denrées alimentaires ou catégories de denrées alimentaires ; (d) les renseignements pertinents à l’évaluation de la sécurité de la substance ; (e) le cas échéant, la méthode d’analyse(s). »
C’est bizarre ce cahier de décharges au niveau transparence, puisque la même Commission Européenne a produit depuis 1993 une série de réglementations imposant jusqu’aux petits producteurs de denrées alimentaires de mettre en place des mesures visant à assurer un niveau de protection élevée, et notamment une traçabilité de la fourche à la fourchette.
C’est clair une protéase, une pentosanase, une oxydase, une lipase ou une amylase c’est différent technologiquement et nutritionnellement.
Et ce qui différenciera un boulanger de son concurrent est majoritairement le diagramme de panification où l’enzyme sera obligatoirement plus ou moins active.
Qui doit faire les choix technologiques en panification, les fournisseurs d’ingrédients ou le boulanger ? C’est l’hémorragie, voire l’appropriation et la standardisation de la compétence professionnelle que l’on entraîne dans de telles démarches trop exclusives au niveau sectoriel dans la filière qui va de la farine au pain. Ce qui peut effrayer dans de telles démarches, ce n’est pas tant qu’un lobby cherche son intérêt, mais qu’il le fasse aux dépens d’autres (en plus ses clients) et que des décisions soient prises sans consultation de tous les secteurs concernés, mais plutôt en réponse face aux lobbyings du secteur économique le plus concerné.
La connaissance scientifique des enzymes devient de plus en plus fine grâce à l’expansion de science comme la biologie moléculaire. Les premières enzymes issues d’Organismes Génétiquement Modifiées seront autorisées en 1994, elles seront dites enzymes « recombinées ». Avec elles, c’est une espèce de rationalisation de la production d’enzymes qui s’opère de plus en plus. Mais de quelle « modification », s’agit-il ? En général, il faut que la modification en vaille la peine. C’est déjà bien clair pour les producteurs d’enzymes : plutôt que d’élever des bovins, les abattre à 18 mois, pour avoir 4.106 unités de présure qui coaguleront le lait en fromage, il est plus facile en ces mêmes 18 mois de produire à l’aide de microorganismes dans cet espace confiné et contrôlable qu’est un grand fermenteur, pour au final avoir l’équivalent de présure de 2.500.000 veaux[276]. Dans notre exemple de production de présure venant d’enzymes microbiens comparé à la production de présure animale (la seule autorisée pour beaucoup de fromages Aoc), on voit bien que l’on dit faire sauter le verrou économique constitué par la limitation de production de présure animale[277]. Cela c’est la parole de producteur d’enzymes, mais vous qui êtes des cultivateurs de ferments quotidiens avec votre levain, vous savez que vous pouvez adapter la production de celui-ci en fonction des besoins. Les fabricants d’enzymes tiennent ainsi, le même discours que les fabricants d’arômes[278]. Et si vous voulez savoir quel est le discours des fabricants d’arômes, il réside sur le fait que rien que pour les produits dit à la fraise consommés aux états-Unis, la production mondiale de fraises ne suffirait que pour assurer 5 % de cette consommation étasunienne. Dès lors, l’arôme fraises provient plutôt de sciure de bois, et les fabricants d’arômes sont devenu des créateurs-parfumeurs très secrets et peu enclins à dévoiler leurs pratiques surtout que la gastronomie pure et dure, réprouvent ses maîtrises par l’ajout de ferments, enzymes et arômes[279].
Comme les producteurs d’enzymes disent eux, qu’il n’existe plus assez de caillette (quatrième estomac) de veaux sur la Terre pour fabriquer tous les fromages qui s’y consomment de nos jours. Dès lors, ce sera dans le matériel génétique d’une levure (Kluyveromyces lactis) que l’on va introduire le gène codant l’enzyme chymosine, coagulant du lait.
Les fabricants d’enzymes explorent surtout du côté des enzymes de microorganismes, dits « extrêmophiles », c’est-à-dire qu’avec des enzymes pouvant vivre dans des conditions « extrêmes » que sont des pH, températures ou pression osmotique « extrêmes » [280].
Ainsi des enzymes résistantes, à la cuisson (l’amylase bactérienne par exemple), à de fortes salinités (ce sera plus fréquent dans le commerce de la viande) ou de basses températures (notamment dans le matériel génétique des levures ou enzymes résistantes à la congélation) sont intéressantes pour l’industrie agro-alimentaire qui cherche toujours l’innovation en même temps que la rationalisation.
Ces gènes extrêmophiles pourront être transmis aux microorganismes producteurs d’enzymes par modification génétique.
Autre transfert de gènes visé, c’est dans la multiplication du gène d’intérêt codant l’enzyme recherché que l’ont veut être actif, pour autant que le microorganisme une fois modifié dans ses chromosomes ne rejette pas ce genre d’accroissement de « greffe génétique ».
Ce dernier type de « recombinaison démultipliée» va améliorer la productivité et à la longue, risque bien de s’imposer face aux productions d’enzymes « non recombinées » au point de les effacer du marché. Un peu comme les enzymes venant de microorganismes ont en moins de dix années quasi supplanté les enzymes d’origine végétale, genre papaïne, « sève » de la papaye, bromélaïne de l’ananas et ficine du figuier. Ces enzymes venant de cultures du Sud sont curieusement employés pour permettre une résistance aux basses températures, notamment en ce qui concerne la ficine pour les pâtes conditionnée au froid[281].
Il faut aussi parler d’une autre pratique en Recherche et Développement des fabricants d’enzymes, l’auto-clonage. Ce type de méthode est défini par la directive européenne[282]. Il s’agit de prendre des gènes dans des cellules de la même espèce ou fort apparentées, celles qui peuvent échanger du matériel génétique par le biais de processus physiologiques naturels. De parfois en retirer une séquence d’ADN et de la réintégrer « nettoyée ». En d’autres termes, si le transfert de l’information génétique est largement limitée à ce qui pourrait se produire naturellement dans une seule espèce, le travail est considéré comme de « l’auto-clonage ». Les lobbys font pression pour que l’auto clonage ne soit pas considéré comme une modification génétique à déclarer.
La déclaration de modification génétique en dissémination étant mal perçue du consommateur, les lobbys fonctionnant par le génétique essayent de faire passer au second degré les produits comme l’enzyme en la dénommant « recombinée » ou depuis peu en évoquant les productions Ogm de deuxième génération ou nouvelle technologie traitée d’édition de gènes (III.1).
La définition de l’auto-clonage qu’ils vont donner par après deviendra plus large. Pour eux, plus besoin d’être lié au niveau génétique, il suffit que les « gènes aient une longue histoire d’utilisation sûre dans l’organisme particulier concerné ».
On le voit toutes les conditions sont là pour que le développement des enzymes en agro-alimentaire s’opère. Quand on fait l’état de la situation en 1996, c’est le secteur des détergents (les enzymes dites « gloutons ») qui tient largement la vedette du volume commercialisé par l’industrie des enzymes (45 %). A cette époque, les besoins pour les industries de cuisson ne couvrent alors que 4 % d’un marché estimé alors, à 6 milliards d’euros[283]. Toutefois de 1997 à 2004, le nombre d’enzymes autorisés en panification française va passer du simple au double[284].
Après les amylases à effets secondaires, ce sera sous leurs vrais noms les pentosanases, (dénommés maintenant dans un sens plus large hémicellulases, ou plus précis xylanases) qui vont dans la dernière décennie du xxe siècle prendre place dans la pâte à pain et donner cet essor. La première xylanase mise sur le marché date de 1973 d’après l’historique de Röhm, ex-partenaire de Puratos sur le marché allemand, devenu AB Maury.
La xylanase sera active dans l’améliorant de panification S 500 de la firme belge. Selon Philippe Mengal, directeur de la recherche appliquée chez Puratos, la découverte des propriétés de l’enzyme xylanase lance le S 500 (version en poudre du T 500) en 1975, « le secret de la xylanase a été gardé précieusement pendant une douzaine d’années[285] », ce qui permit un avantage compétitif vis à vis de la concurrence. Pour beaucoup, l’ajout d’hémicellulases sera une découverte technologique, comme un nouvel apport.
Au cours de la première décennie du xxie siècle, les lipases dont on ne pensait pas qu’elles puissent jouer un rôle important vont s’installer dans la gamme des propositions enzymatiques à la panification.
Lutz Popper de Mülhenchemie, en 2009, écrit que « le succès actuel des enzymes lipolytiques est en train d’impulser une nouvelle dynamique d’évolution ». Novozymes lancera sa lipase boulangère, dénommée Lipopan en 1998.
Ce marché de l’enzyme pour le secteur boulangerie arrive même à présenter de nouveaux acteurs, ce qui occasionne une concurrence accrue. Les fabricants d’adjuvants et de grandes meuneries ont investi dans ce secteur (XVI.2).
D’après les firmes productrices, il faut trois à cinq années de recherche en moyenne, plus deux ans d’accréditation pour mettre au point une enzyme qui pourrait faire une carrière commerciale. Un dossier d’agréation coûte entre 200 000,00 € et 260 000,00 € afin de couvrir les études toxicologiques entre autres.
Voulant harmoniser le marché par sa directive, l’Europe précise qu’elle fera l’estimation des enzymes par son organisme, l’Efsa, Autorité Européenne de la sécurité alimentaire basée à Parme en Italie. L’ Efsa avait mis en ligne un document d’orientation précisant le type d’information que l’industrie doit fournir pour permettre à cet organisme européen d’effectuer les appréciations de sécurité sur l’utilisation d’enzymes que nous avons vu plus haut.
L’évaluation de sécurité doit faire face aux propriétés toxicologiques de la préparation enzymatique. Il faut prouver l’absence dans quelques grammes, de microorganismes pathogènes (de type Salmonelle, Staphylocoque doré, Escheria coli, Listeria, etc.), mais aussi absence d’antibiotiques et de toxines (surtout mycotoxines) produites par des moisissures quelquefois utilisées comme souches productrices dans les « fermenteurs à enzyme ». C’est le cas d’Aspergillus Niger dont certaines souches peuvent produire des mycotoxines et des enzymes recombinées (VI.8 à VI.10).
Des contaminations par métaux lourds sont sujettes à contrôle. Plomb, mercure, cadmium et arsenic dû au procédé de production, filtration et purification. Pour la sécurité alimentaire de l’enzyme soumis à la dissémination dans notre environnement, celle-ci doit répondre à des assurances plus précises. Le calcul des facteurs objectifs de sécurité n’est pas simple et que dire alors qu’il s’agit d’enzymes recombinées. Dans ce cas, une analyse complète de la procédure de modification génétique est nécessaire, en tenant compte de l’organisme donneur, l’organisme hôte, l’identité et la caractérisation des vecteurs et des séquences de nucléotides insérés, l’utilisation des gènes marqueurs, tels que les antibiotiques, les transferts de gènes de résistance.
On devrait pouvoir évaluer la quantité de l’enzyme consommé dans le cas où elle se retrouve dans la denrée consommée. Mais comment le faire si sur l’emballage elles ne sont pas bien signalées ?
XVI.13. L’ajout d’enzyme et l’asthme du boulanger
Le fait que la préparation enzymatique peut provoquer des allergies et des irritations implique également un suivi sanitaire et cela prend encore plus d’importance pour les opérateurs travaillant avec la matière active qu’est l’enzyme, comme les boulanger(e)s.
Il suffit de lire les précautions d’emploi et de manutention inscrites sur les emballages de produits enzymatiques pour se rendre compte que leurs manipulations ne sont pas sans danger pour les boulanger(e)s. Le consommateur n’ayant certainement pas à souffrir du même risque puisqu’il mange le pain cuit et que normalement les enzymes sont détruites à la cuisson.
Regardons ce qui s’est passé à la fin des années 1960 en Angleterre. Il existait de nombreux cas d’irritations, d’allergies de contact (eczéma) et même de réactions asthmatiques dus aux « enzymes gloutons » (des protéases) des produits de lessives.
En fait, plus que « manger » les taches, les enzymes dites gloutons les dégradent en petites parties afin que l’eau de nettoyage puisse les enlever, et cela se passe par une action qui est enzymatique. L’allergie de contact (eczéma) était présente aussi bien chez les consommateurs, qu’évidemment chez les ouvriers employés dans les productions d’enzymes et de poudre à de lessive. La teneur en enzymes a dû être réduite dans les lessives et parfois on l’a exclu. Sur le sol britannique, la proposition commerciale est claire.
Dans la législation britannique sur les produits nettoyants, une réponse à cette critique allergène a été donnée dans l’étiquetage. Les produits nettoyants sont soit étiquetés depuis 1960, « Non Biological » soit sans enzymes, ou « Biological » avec des enzymes inclus dans les poudres de lessive. Mais pourquoi n’indique-t-on rien dans la publicité obligatoire des produits alimentaires, ce qui est plus crucial qu’un produit nettoyant quand même ?
Bien sur, on a amélioré le processus de fabrication au niveau de la sécurité et des procédés. Dans les unités de production d’enzymes comme dans les usines de productions de pénicilline et d’antibiotiques (on y travaille pratiquement en scaphandre), on évite le contact direct et pratique l’épuration de l’air respiré par les travailleurs.
Sans subir les mêmes concentrations de protéines actives que dans les productions d’enzymes plus concentrées, l’atelier où se transforme la farine en pain doit pouvoir éviter de trop fort empoussiérage. La pesée des matières premières et des pâtons, le remplissage du pétrin avec la farine, le début du pétrissage, l’enfarinement des couches ou panetons, ou encore lors du façonnage ou de l’abaisse des pâtons. Tous ces points sont les endroits et les instants les plus critiques (fig.39). Une réponse fut également apportée sporadiquement par les fabricants de matières premières manipulées par la boulangerie, c’est l’enrobage à l’aide d’huile ou de gluten, des compositions enzymatiques pour tenter de faire barrière entre la protéine allergène et les travailleurs de la farine contenant des enzymes.
| fig.39. Taux de poussière suivant divers postes de travail dans une boulangerie industrielle | |
| Poste de travail | Taux de poussière
en mg au m³ |
| Ambiance générale | 1,6 mg |
| Poste Feuilletage
(dans enceinte confinée) |
36,8 mg |
| Poste ciabattas
(pâte fortement farinée) |
33,1 mg |
| Poste pistolets | 6,3 mg |
| Poste Pétrissage
(fort dégagement au début) |
5,8 mg |
| D’après PONCIN, 1994. | |
Nous, les boulanger(e)s, respirons par jour ± 12 m² d’air. L’air d’un atelier comporte ± 3 milligrammes (3 millièmes de grammes) de poussière de farine au m², chiffre d’une grande enquête danoise[286] sur le sujet. Dans les boulangeries artisanales, la moyenne se situe à 96 % de cette valeur limite et est nettement dépassée dans les boulangeries industrielles[287]. Là, on signale que la norme de 10 milligrammes de poussière est également celle reconnue par l’Acgih (Association Advancing Occupational and Environmental Health) comme officielle pour les poussières minérales non fibrosantes. Cette norme est le seuil d’empoussièrement français et anglais, mais les allemands et danois descendent respectivement jusqu’à 4 et 3 milligrammes[288].
Ces particules de poussière de farine que l’on voit aisément lorsqu’un rayon de soleil filtre dans l’atelier restent en suspension dans l’air ambiant en voltigeant. La fréquence des courants d’air chaud (appelant 1’air froid) due aux enfournements et détournements créent suffisamment ce que la météo appelle des dépressions pour que cela se passe ainsi.
Nous vivons dans une ambiance pratiquement close pour respecter les paramètres (température, humidité de l’air et absence de courants d’air) qu’exige la bonne conduite d’une fermentation de pâte.
 Ces conditions étaient pires autrefois : atelier dans des caves mal aérées, pétrissages manuels, battage des sacs de jute à la main et plus d’efforts physiques amenant une inspiration plus intensive. On peut se souvenir de ce surnom du boulanger, sans doute mérité, en ce début de xxe siècle, « le mineur blanc ». Les historiens Steven L. Kaplan et Laurent Bourcier signalent[289] que M. Bouteloup l’avait cité dans son ouvrage[290], « Le travail de nuit dans la boulangerie à Paris », en 1909.
Ces conditions étaient pires autrefois : atelier dans des caves mal aérées, pétrissages manuels, battage des sacs de jute à la main et plus d’efforts physiques amenant une inspiration plus intensive. On peut se souvenir de ce surnom du boulanger, sans doute mérité, en ce début de xxe siècle, « le mineur blanc ». Les historiens Steven L. Kaplan et Laurent Bourcier signalent[289] que M. Bouteloup l’avait cité dans son ouvrage[290], « Le travail de nuit dans la boulangerie à Paris », en 1909.
L’expression « Mineur blanc » sera reprise en titre de livre, un an plus tard par le député lyonnais Justin Godard[291].
L’analogie mineur/boulanger s’arrête au travail dans la poussière et l’obscurité.
La silicose du mineur est cataloguée comme une pneumoconiose, pas comme une allergie. Les poussières minérales inhalées (dans le cas du mineur, de silice) vont s’accumuler dans les poumons et provoquer des difficultés respiratoires.
Une des plus anciennes mentions d’asthme des boulangers et meuniers est à l’actif de Bernadino Ramazzini qui dans « De Morbis artificum diatriba », soit « Traité des maladies des artisans » en 1700, écrit que les professionnels de ces deux métiers (meuniers et boulangers) deviennent en peu de temps sujets à la toux, essoufflés, enroués et enfin asthmatiques, le masque en toile de lin était déjà d’usage préventif[292]. Transcris du wallon, on appelait cela « être court d’haleine ».
Une polémique s’est engagée au sujet de l’enzyme et l’allergie en Allemagne. L’émission « Monitor » diffusée sur l’Ard (télévision allemande), le 13 janvier 1992 a mis en cause l’introduction « de la chimie » dans le pain. Réalisée avec beaucoup de légèreté au niveau de l’appui scientifique de l’argumentaire, elle a suscité de vives émotions et réactions. Le rôle allergique de l’αlpha-amylase étant notamment mis en cause, un boulanger ayant eu une réaction en apposant sur la peau ce produit.
Une enquête française de 1988 relevait que 34 % des boulangers asthmatiques étaient sensibilisés à l’αlpha-amylase. Lors d’une enquête néerlandaise en 1997, publiée par Walter Geluyckens dans « Bakkerswereld » l’association nationale des producteurs d’améliorants (Nefaba) s’était montré choquée que l’αlpha-amylase était mis en cause et alla jusqu’à proposer d’asperger l’améliorant (enzyme) avec de l’huile et de la graisse, un peu le même principe que les « farines lourdes ». En effet, un moulin allemand a présenté dans le début des années 1990, une farine appelée Staub Minus, trad. : Poussière minimale. Cette farine est étudiée pour produire moins de poussière.
Actuellement, une étude danoise donne des mesures de 95 à 96 % de poussières en moins avec ces farines « lourdes ». Cette farine spéciale est traitée et au stade de nos recherches, seul l’étiquetage nous renseigne quelque peu, elle « contient de l’huile animale durcie ». Elle coûtait à l’époque autour du double de la farine normale. L’enquête danoise donne sur laminoir une réduction de poussière de 73 % en manuel et 83 % en farineur automatique[293] par rapport à une farine non traitée.
En Belgique, une moyenne établie sur six années de 1988 à 1993 donne le chiffre de 55,8 nouveaux cas d’asthme ou eczéma reconnus par année.
En France, l’observatoire national des asthmes professionnels, après enquête, fait apparaître que 20 % des causes d’asthme professionnel sont dus à la farine[294].
Si l’on résume les solutions préventives pour lutter contre l’allergie du boulanger de manière autre que les médications, c’est par la réduction de poussières de farine dans un fournil, que l’on pratique.
Mais, c’est le cumul de conditions onéreuses : appareils d’aspiration fixes à flux laminaire sur tous les points de poussiérage, épuration à l’aide d’un filtre puissant, par conséquent d’un système d’aspiration puissant et relargage de l’air aspiré filtré afin de ne pas modifier la température.
Ainsi il n’est pas rare de trouver des installations qui dépassent allégrement les 25 000,00 euros.
Malheureusement le niveau de financement risque dans ces cas de déterminer si l’action préventive sera entreprise ou pas. Ici, pourtant nous ne sommes pas devant un choix où la libre concurrence imposée a ses raisons d’être, puisqu’il s’agit de notre santé.
| fig.41. Les diverses maladies liées aux céréales | |||
| Maladie cœliaque | Allergies digestives non cœliaques | Farinose
(Asthme-Eczéma) |
|
| Affection système | Affecte le système digestif | Affecte les systèmes digestif et de circulation | Affecte le système respiratoire |
| Découverte en … | Citée très tôt, puis recherche en 1888
(Dr. Gee), et 1950 (Dr.W.C.Wicke) |
1996 (Dr. Seignalet),
2011 (Dr.Davis) |
1770, cité dans Ramazzini |
| Diagnostic | Affecte les villosités de l’intestin | Récent, encore mal défini et parfois divers | Maladie professionnel |
| Allergène le plus cités | Protéines insolubles ou gluten avec l’αα-gliadine | Céréales avec gluten de haut poids moléculaires | Poussière de farine
Surtout protéines solubles |
| Soins | Exclusion stricte du gluten dans l’alimentation
(moins de 0,02 gr.) |
Exclusion du gluten du régime diététique | Moins de 4mg. de poussière au m³ |
| D’après RAMAZZINI, 1770, SEIGNALET, 2004, DAVIS, 2012, FASANO, 2017. | |||
- Bibliographie du Chapitre XVI L’amélioration et l’améliorantPaul Malouin, 1767, p. 224. ↑
- O. Hilmann, p. 45. ↑
- Raymond Calvel, janvier 1988, p. 20. ↑
- Antoine Parmentier, 1778, p. 351-352. ↑
- P. Malouin, 1767, p. 218, 221-222. ↑
- Charles Semertier, p. 271. ↑
- Site du Syfab.fr ↑
- Site de l’unifa.be/start/home/fr ↑
- Site de la fedima.org ↑
- Revue publicitaire de Puratos Entre Nous, no 58 de 1981. ↑
- Site unifa.be/start/publicaties/fr ↑
- L.G. Rancoule, p. 10. ↑
- Site zeelandia.fr ↑
- Revue publicitaire L’écho de Zeelandia no 2, 1973. ↑
- R. Calvel, 1978, p. 336 ; A. Roig, p. 54. ↑
- R. Van Santbergen, 1953, p. 100. ↑
- S.Kaplan, 2020, p. 316. ↑
- M. Apfelbaum et al., p. 99-101. ↑
- Site puratos.com ↑
- Site puratos.com/about/History/default.aspx ↑
- Revue L’Écho de Zeelandia no 2, 1972. ↑
- John Yudkin, p. 290. ↑
- Dan Morgan, p. 103. ↑
- Revue belge, Vie Professionnelle, février 1989. ↑
- Publicité du Syndicat National des fabricants de farine de fève dans Les Nouvelles de la Boulangerie, n° 416 du 15-10-1993. ↑
- http://www.eurogerm.com/nouveau/FR/entreprise/entreprise.php?page=historique ↑
- Fabien Faisy et Olivier Neyereneuf, p. 3-12. ↑
- Site unifa.be/_STUDIOEMMA_WWW/images/publicaties/Brochure_Boulangerie_2006_08.pdf ↑
- Site syfab.fr/Default/5/225/225/support-pedagogique ↑
- Site bioeco.canalblog.com/archives/2008/02/10/7896324.html ↑
- P.Clément, p.22-23. ↑
- Arrêté Royal relatif aux adjuvants pour produits à base de farine du 02/09/1985 publié au Moniteur Belge le 07/11/1985, art.1er 3°. ↑
- J.Bassot, p.551. ↑
- Philippe Roussel, 1998, p. 596 ; Bruno Guéhin, et al., p.116. ; J.Bassot, p.552. ↑
- J.Bassot, p.554. ↑
- J.Bassot, p.555. ↑
- Supplément technique INBP « Les produits de panification à l’heure européenne » du 15 avril 1997, p. 16 ; Philippe Roussel, 1998, p. 596-602. ↑
- N.Amrane, 2012, p.25. ↑
- R. Drapron et al., 1974, p.156 – 159 ; R. Drapron et al., 2005, p. 135-136. ↑
- Le bi-mensuel, Les Nouvelles de la boulangerie, n° 416 du 15-10-1993. ↑
- J. Denise, p. 789-795. ↑
- J. Klere, p. 8. ↑
- L. Faur, p. 883. ↑
- Jean-Marie Bourre, dans Les Ambassadeurs du pain, 2019, p.10-11. ↑
- N. Combe, A. Grangirard, p. 652. ↑
- L’Arrêté relatif aux pains et autres produits de boulangerie du 01/12/1986. ↑
- R. Guinet, A. Charlegelegue, p. 133. ↑
- J.-L. Doublier, p. 23. ↑
- J.-L. Doublier, p. 92. ↑
- A. Roig, p. 483. ↑
- Yves Dacosta, 1986, page d’introduction. ↑
- G. Decourcelle, 1991, p. 46. ↑
- P. Roussel, H. Chiron, 2002, p. 108. ↑
- Yves Dacosta, 1986, p. 102-104. ↑
- L’Arrêté relatif aux pains et autres produits de boulangerie du 02/09/1985 publié au Moniteur Belge le 7 novembre 1985. ↑
- S.Kaplan, 2020, p.162 – 166. ↑
- Daniel Pécot, p. 28-29 ; R. Pluchet, p. 35-38. ↑
- Cahier des Charges Nature & Progrès, p. II.4. ↑
- O. Darde et al., p. 4. ↑
- Jean Bure, 1980, p. 15. ↑
- Y. Dacosta, 1986, p. 19-21. ↑
- L. Ammann, p. 333, 334. ↑
- Valérie Mélas et al., p. 3. ↑
- P. Joudrier & coll., p. 13. ↑
- Y. Dacosta, 1986, p. 25-28. ↑
- Pr. Raymond Calvel, 1978. ↑
- Philippe Roussel, p. 604. ↑
- Journal Officiel belge, Le Moniteur Belge du 7 novembre 1985 publiant les arrêtés royaux du 2 septembre 1985 relatifs à la farine et aux pains et autres produits de boulangerie. ↑
- O. Darde, p. 9. ↑
- O. Darde, p. 2-9. ↑
- G. Martin, 1994, p. 8. ↑
- P. Feillet, 1999, p. 5. ↑
- G. Martin, 1995, p. 15. ↑
- J. Abecassis, 1997, p. 17. ↑
- Y. Dacosta, 1986, p. 29. ↑
- Y. Dacosta, 1986, p. 65, 66 ; S. Berot et B. Godon, p. 75. ↑
- S. Berot et B. Godon, p. 75. ↑
- Yves Dacosta, 1986, page d’introduction. ↑
- Vincent Oldenhove, p. 145. ↑
- Yves Dacosta, 1986, p. 109-114. ↑
- A. Bonjean, 2000, p. 70. ↑
- Site codexalimentarius.net/web/index_fr.jsp ↑
- Site ec.europa.eu/food/fs/sfp/addit_flavor/flav11_fr.pdf ↑
- L.G. Rancoule, p. 3 & 9. ↑
- Steven Kaplan, 2008, p. 721 et p. 722. ↑
- Jean Bure, 1980, p. 136. ↑
- Daniel Pécot, p. 49. ↑
- Loïc Louarme, p. 3-6. ↑
- https://www.passeportsante.net/fr/Actualites/Nouvelles/Fiche.aspx?doc=pain-industriel-sante-bromate-potassium ↑
- Loïc Louarme, p. 3-6. ↑
- Article sur le Bromate de potassium sur Wikipédia. https://fr.wikipedia.org/wiki/Bromate_de_potassium ↑
- Directive EC 2092/91 du 24 juin 1991, version consolidée et les règlements additionnels mis à jour sont téléchargeables à ces adresses www.ecocert.fr ou www.certisys.be. ↑
- Michael Pickel et Bo Pedersen, IFOAM, décembre 1990 ; Marc Dewalque, 1989. ↑
- Jean Buré, 1980, p. 135. ↑
- Raymond Calvel, mars 1989, p. 24. ↑
- Dr. Daniel Pecot, p. 49. ↑
- John Yudkin, p. 422. ↑
- Voir J. Bure, 1980, p. 136, p. 139. ↑
- Philippe Roussel, 1991, p. 606. ↑
- J. Bure, 1980, p. 139. ↑
- Raymond Calvel, février 1985. ↑
- Le Moniteur Belge du 27 février 1986, p. 2581. ↑
- L’arrêté du 27-07-1978, voir Le Moniteur Belge du 20 octobre 1978, p. 12561. ↑
- La revue, Énergie Santé, a traité la question (nos 13, 18 et 20). ↑
- Raymond Calvel, février 1985, p. 6. ↑
- Raymond Calvel, mars 1989, p. 24-26. ↑
- Stanley P. Cauvain, Linda S. Young, 192 pages, 2005. ↑
- R. Guinet et A. Charlegelegue, 1983, p. 133. ↑
- Hubert Chiron, 1993, p. 14. ↑
- L’Écho de Zeelandia, no 2 de 1973. ↑
- François-Régis Gaudry dans Valérie Lepla, p.5. ↑
- Journal Officiel belge, Le Moniteur Belge du 7 novembre 1985. Arrêtés royaux relatifs à la farine et aux pains et autres produits de boulangerie ↑
- Revue publicitaire de 1962 de la firme DEBCO, filiale d’UNILEVER à l’époque. ↑
- Paul Magnette, p.22. ↑
- R. Calvel, février 1985, p. 25. ↑
- S.L. Kaplan, 2002, p. 265. ↑
- Arrêté du 02 octobre 1980 publié au Moniteur Belge du 16 janvier 1981, p. 472. ↑
- P. Wirsta et al., 2003, p. 2-6 et 2004, p. 2-9. ↑
- Moniteur Belge du 16 janvier 1981, p. 472. ↑
- Jürgen-Michael Brümmer, 1990, p. 36. ↑
- Steven Kaplan, 2002, p.321-330. ↑
- Ordonnance (allemande) du 22 décembre 1981 sur l’emploi des denrées alimentaires modifiée le 19 juin 1989. ↑
- F.W. Fouassier, p. 63. ↑
- Eddy Van Belle, mars 1989, p.41. ↑
- R. Calvel, octobre 1988, p. 15-18. ↑
- Revue Filière gourmande d’octobre 1993. ↑
- Revue Le Moniteur de la fédération francophone de boulangerie, octobre 2020, p.7 ↑
- Site ffinetwork.org/about/languages/documents/ToolKitFrench.pdf ↑
- Site micronutrient.org/fr ↑
- Site gainhealth.org ↑
- Thierry Souccar et Isabelle Robard, p. 125-126 et 134-139. ↑
- Hans-Ulrich Grimm, 2004, p. 42. ↑
- Agathe Mahuet, 2012. ↑
- Emma Flipon, 108 pages, principalement p.18 à 26. ↑
- Bertrand Delpeuch, p.24 à 48. ↑
- Dan Morgan, 1979, le chapitre 1, p. 15 à 36. ↑
- Oliver Morrison, sur Food Navigator, le 25-05-2020. ↑
- Aurélie Trouvé, p.83-93. ↑
- Florence Thinard, 240 pages. ↑
- Revue de l’Industrie Alimentaire d’octobre 1995. ↑
- Loïc Louarme, juillet 2004. ↑
- S. Beague, V. Lechevalier, p. 31. ↑
- Anselme Payen, J.-F. Persoz, p. 73-92. ↑
- Émile Bourquelot, p. 13-62. ↑
- Hermann Emil Fischer, p. 2985-2993. ↑
- Léon Boutroux, 1897, p. 96, 97. ↑
- Raymond Geoffroy, 1950, p. 180 et p. 210 – 219. ↑
- Ambroise Morel, p. 427. ↑
- Philippe Roussel et Hubert Chiron, p.150. ↑
- Philippe Roussel, 1998, p. 580-585. ↑
- Sites : www.weyermann.de et www.aromatic.se ↑
- Site puratos.com/about/history/default.aspx ↑
- Manuel de boulangerie-pâtisserie suisse, 1949, p. 71- 72. ↑
- J. Stolkowski, p. 119. ↑
- Roger Drapron, 1996. ↑
- E.A. Farrand, p. 98-111. ↑
- Jean Buré, 1980, p. 68. ↑
- J. Potus, R. Drapron et A. Poiffait, p. 430. ↑
- Jérôme Souppe, 1997, p. 299. ↑
- Site muehlenchemie.de/ ↑
- Jérôme Souppe, p. 299. ↑
- P. Besancon, p. 23. ↑
- Roger Drapron, 1996, p. 2. ↑
- Philippe Roussel, 1998, p. 582. ↑
- Fabien Faisy et Olivier Neyerneuf, 1996, p. 3-12. ↑
- Directive 89/107/CEE, art. 1er point 3. ↑
- A. Ouali, p. 78-81 ; P. Roy, p. 95-105. ↑
- M. Apfelbaum, p. 309. ↑
- D. Rawn, Traité de biochimie, 1990, p. 924. ↑
- Yves Dacosta, 1986, p. 5, 6. ↑
- Sven Neu & Karl Ransberger, 1992. ↑
- R. Drapron et al., 2005, p. 108. ↑
- N.Amrane, p. 64. ↑
- J. Adrian et A. Poiffait, p. 5. ↑
- Yves Dacosta, 1986, p. 30. ↑
- P. Valdebouze & D. Tome, 1984, p. 364-368. ↑
- Yves Dacosta, 1986, p. 30. ↑
- Edward Howel, p. 127 à 136. ↑
- V. Leloup, P.Colonna et A.Buléon, p.79. ↑
- G. Spicher, 1993, p. 40. ↑
- Stéphane Neron, p. 5-18. ↑
- Claude Willm, 2005, p. 23. ↑
- Bernard Godon, 1991, p. 16-17. ↑
- Jacques Potus, F. El Amrani, V. Ameille et N. Kaid, p. 11. ↑
- Philippe Castello, J. Potus, J.-L. Barret et J. Nicolas, 1998, p. 5-13. ↑
- Ph. Wirsta & coll., mars 2006, p. 9-13. ↑
- Jacques Potus, F. El Amrani, V. Ameille et N. Kaid, 1996, p. 12. ↑
- R. Desgrez, p. 139-145. ↑
- Philippe Roussel, 1998, p. 596-602. ↑
- R. Drapron, Y. Beaux, M. Cormier, J .Geffroy et J. Adrian, 1974, p. 353 -365. ↑
- Michel Berger, p. 40. ↑
- Yves Dacosta, 1986, p. 29. ↑
- R. Geoffroy, 1950, p. 213. ↑
- Annie Poiffait, Jacques Potus et Roger Drapron, juin 1993, p. 8-10. ↑
- P. Roussel, 1998, p. 580. ↑
- V. Leloup, P. Colonna & A. Buleon en 1991, p. 79. ↑
- Bernard Poitrenaud, 1994, p. 177. ↑
- C. Gancedo et R. Serrano, p. 211. ↑
- Gottfried Spicher, 1987, p. 75, 95. ↑
- T. Lender, R. Delavault et A. Le Moinge en 1992, p. 332. ↑
- Michel Berger, 1983, p. 42. ↑
- Bernard Poitrenaud, 1994, p. 177. ↑
- Bernard Poitrenaud, 1994, p. 178. ↑
- V. Leloup et al., p. 82. ↑
- C. Mercier et M.T. Tollier, 1984, p. 320. ↑
- V. Leloup et al., 1991, p. 86. ↑
- V. Leloup et al., p. 122. ↑
- V. Leloup et al., p. 124. ↑
- Émile Dufour, p. 178. ↑
- Lionel Poilâne, 1981, p. 104. ↑
- Jacques Potus, F. El Amrani, V. Ameille et N. Kaid, 1996, p. 10, 11. ↑
- Gottfried Spicher et Hans Stephan, 1993, p. 215. ↑
- Y. Dacosta, 1986, p. 15. ↑
- Yves Popineau et al., p. 129, 132. ↑
- Yves Popineau et al., p. 14. ↑
- Y. Dacosta, 1986, p. 17. ↑
- J.-Y. Leveau, 1983, p. 6. ↑
- Bernard Poitrenaud, 1994, p. 174. ↑
- Bernard Poitrenaud, 1994, p. 175. ↑
- Stéphane Beague et Vincent Lechevalier, de la société Lesaffre, 2005, p. 29-37. ↑
- Gottfried Spicher et Hans Stephan, 1987, p. 44 à 49. ↑
- Raymond Calvel, 1979, p. 57. ↑
- Y. Dacosta, 1986, p. 17. ↑
- B. Onno et P. Roussel, p. 309. ↑
- A.A. Parmentier, 1778, p. 25. ↑
- X. Rouau, p. 16. ↑
- X. Rouau, p. 17. ↑
- X. Rouau, p. 16. ↑
- H. Petrich-Murray et P. Ducroo, p. 14. ↑
- H. Petrich-Murray et P. Ducroo, p. 14. ↑
- X. Rouau, p. 14. ↑
- H. Petrich-Murray et P. Ducroo, p. 14. ↑
- X. Rouau, p. 17, 18 ; H. Petrich-Murray et P. Ducroo, p. 13. ↑
- X. Rouau, p. 18. ↑
- H. Petrich-Murray et P. Ducroo, p. 14. ; F. Dellaglio et al. ↑
- Guylaine Lacaze, M. Wick, S. Cappelle, p. 155-160. ↑
- Saeid Bathaei, p. 30. ↑
- Fanny Leenhardt, p. 133-134. ↑
- R. Drapron et al., 2005, p. 96. ↑
- R. Amado, E. Arrigoni et A. Caprez, 1987. ↑
- Henri Nuret, cité dans Claude Willm, 2005, p. 23. ↑
- G. Spicher, 1987, p. 141-143. ↑
- G. Spicher, 1987, p. 48. ↑
- Communication sur le site de la firme Novozymes, capture d’écran en 2017. ↑
- Communication sur le site de la firme Novozymes, capture d’écran en 2019. ↑
- Introduction sur les enzymes de boulangerie, communication pour Novamyl de Novozymes le 05-11-2015. ↑
- J. Potus et J.Nicolas, 2009 – 2010, p.3 et p.7 à 11. ↑
- Cécile Chevreux, mars 2002. ↑
- N.Amrane,2012, p.66. ↑
- J. Potus et al., 1996, p. 10. ↑
- B. Godon, 1994, p. 425. ↑
- J. Potus, R. Drapron et A. Poiffait, 1994, p. 441. ↑
- Potus et R. Drapron, 1997, p. 126. ↑
- Directive 89/107/CEE, art. 1er point 3. ↑
- Bernard Godon, 1998, p. 58. ↑
- Lutz Popper de Mühlenchemie, p. 1. ↑
- Sites de ces deux firmes : abenzymes.com et muehlenchemie.de ↑
- J.-P. Larpent et M. Larpent-Gourgaud, p. 328. ↑
- H. Petrich-Murray et P. Ducroo, p. 13. ↑
- L. Rakotozafy et coll., mai 2008, p. 19. ↑
- Jacques Potus et col., 1999, p 7. ↑
- O. de Serres, p. 816, 817. ↑
- O. de Serres, p. 104. ↑
- R. Calvel, avril 1980. ↑
- P. Malouin, 1767, p. 237-238, 266. ↑
- J. Potus et coll., mars 2010. p. 3, 4. ↑
- A. Eyoum et coll., p. 6-13. ↑
- Masood Dehkarghanian et coll., p. 15-20. ↑
- J. Potus, J. Nicolas, mars 2010. p. 7. ↑
- R. Drapron et al., 1974, p. 353-365. ↑
- A. Boussard et coll., mai 2010, p. 9 à 11 et octobre 2010, p.5 à 9. ↑
- R. Drapron et D. Richard-Molard, 1979, p. 149. ↑
- R. Calvel, mai 1981, p. 273, et éditorial de décembre 1986. ↑
- Jacques Potus, éditorial de la revue Industries des Céréales, juillet 2004. ↑
- Site brenda-enzymes.org et chem.qmul.ac.uk/iubmb/enzyme/index.html ↑
- Jérôme Souppe, p. 300. ↑
- N.Amrane, 2012, p. 70. ↑
- Hans-Ulrich Grimm, 2004, p.20. ↑
- Hans-Ulrich Grimm, 2004, p.11 à 26. ↑
- G. Barbier, 1997, p. 286-340. ↑
- Antoine Roig, 1988, p. 505-507. ↑
- Voir le règlement CE 2009/41, annexe 2. ↑
- Véronique Laretta-Garde, 1997, p. 4, 5. ↑
- Loïc Louarme, juillet 2004. ↑
- Revue Filière Gourmande n° 100 d’octobre 2003, p. 12. ↑
- Rolf Hangaard Nielsen, p. 7. ↑
- C. Poncin, p. 9. ↑
- F. Landgraf, p. 31-33. ↑
- S.L. Kaplan, 1993, p. 235-271 ; Laurent Bourcier, p.406. ↑
- Maurice Bouteloup, 1909, 269 pages. ↑
- Justin Godard, 1910, 150 pages. ↑
- D. Choudat, p. 22 ; S.Kaplan, 2020, p.76. ↑
- Les poussières de farine, dans le Supplément Technique INBP no 48 du 1 janvier 1996, p. 12-13. ↑
- Transparent du docteur Vandeweyer, pneumologue au Fonds des Maladies Professionnelles Belge en 1993 ; D. Choudat, p. 22-23. ↑